Журнал «Травма» Том 11, №1, 2010
Вернуться к номеру
Прогнозирование исхода крайне тяжелой черепно-мозговой травмы. Диагностика смерти мозга
Авторы: Г.А. Городник - Донецкий национальный медицинский университет им. М. Горького, Донецкое областное клиническое территориальное медицинское объединение, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Представлены данные клинического, неврологического, биохимического, электроэнцефалографического обследований, ультразвуковой транскраниальной допплерографии, компьютерной томографии 30 пациентов в возрасте от 16 до 40 лет с тяжелой ЧМТ (неблагоприятный исход). Применяли метод логарифмических индексов параметров количественной ЭЭГ – абсолютной спектральной мощности и суммарной межполушарной когерентности. Использовали способ прогнозирования исхода путем оценки состояния мозгового кровотока за счет проведения серии компьютерных томограмм, измерения плотности вещества мозга до и после внутривенного введения контраста и расчета разности изменения плотности во времени (ПАТЕНТ N 1809757). Данный комплекс исследований позволил выявить прекращение функций головного мозга и установить необратимый характер этого прекращения, диагностировать смерть мозга, которая является эквивалентом смерти человека.
Представлено дані клінічного, неврологічного, біохімічного, електроенцефалографічного обстежень, ультразвукової транскраніальної доплерографії, комп''ютерної томографії 30 пацієнтів у віці від 16 до 40 років з важкою ЧМТ (не-сприятливий результат). Застосовували метод логарифмічних індексів параметрів кількісної ЕЕГ – абсолютної спектральної потужності й сумарної міжпівкульової когерентності. Використовували спосіб прогнозування результа-ту шляхом оцінки достатності мозкового кровотоку за рахунок проведення серії комп''ютерних томограм, виміру щільності речовини мозку до і після внутрішньовенного введення контрасту і розрахунку різниці зміни щільності в часі (ПАТЕНТ N 1809757). Даний комплекс досліджень дозволив виявити припинення функцій головного мозку і встановити незворотний характер цього припинення, діагностувати смерть мозку, яка є еквівалентом смерті людини.
Information about clinical, neurological, biochemical, electroencephalographical inspections, ultrasonic transcraniale dop-plerography, and computer tomography among 30 patients in the age from 16 to 40 years with heavy craniocerebral trauma (unfavorable end) is presented. The method of logarithmic indexes of quantitative EEG parameters – absolute spectral power and total between-hemispheres coherentness – was applied. The method of the end prognosis by the estimation of the state of cerebral blood stream, due to conducting of series of computer tomograms, measuring closeness of brains matter before and after intravenous introduction of contrast and calculation of changes difference the closeness in time was used (PATENT of N 1809757). This complex of researches allowed exposing breaking the functions of cerebrum and setting irreversible character of this breaking, diagnosing death of brain, which is the equivalent of death of human.
тяжелая черепно-мозговая травма, отек-набухание, количественная ЭЭГ, метод логарифмических индексов, ультразвуковая транскраниальная допплерография, способ прогнозирования исхода, смерть мозга
важка черепно-мозкова травма, набряк-набухання, кількісна ЕЕГ, метод логарифмічних індексів, ультразвукова транс краніальна доплерографія, спосіб прогнозування результату, смерть мозку
heavy craniocerebral trauma, edema-swelling, quantitative EEG, method of logarithmic indexes, ultrasonic transcraniale dopplerography, method of end prognostication, death of brain
Головной мозг регулирует взаимоотношения организма с окружающей средой, управляя поведенческими реакциями и функциями организма. При любом критическом состоянии, особенно крайне тяжелой черепно-мозговой травме, мозг страдает в наибольшей степени, так как переносимость им экстремального воздействия минимальна [13]. Неспособность мозга обеспечить центральную регуляцию функций организма определяется понятием «острая церебральная недостаточность» [4]. Исключительная важность оценки функционального состояния мозга как регулирующего органа связана с таким понятием, как смерть мозга, при котором даже сохранение деятельности сердца, почек и т.д. не противоречит установлению диагноза смерти организма как целого и прекращению реанимационных мероприятий [1,9,11,14].
Целью настоящего исследования является усовершенствование методологического подхода к оценке функционального состояния головного мозга при необратимом травматическом повреждении.
Материал и методы
Обследовано 30 больных в возрасте от 18 до 60 лет, находящихся на лечении в нейрохирургическом центре ДОКТМО в критическом состоянии с первичным повреждением головного мозга. Объем исследования у пострадавших включал: определение глубины коматозного состояния (шкала ком Глазго - ШКГ); первичная оценка функционального состояния ЦНС (компьютерная томография – КТ по разработанным методикам) [8,9]; мониторинг электроэнцефалографии с определением доли функционирующих нейронов (ДФН) и доли нормально функционирующих нейронов (ДНФН) [2], исследование логарифмических индексов параметров количественной ЭЭГ [12]; динамическая оценка мозгового кровотока (ультразвуковая транскраниальная допплерография - УЗДГ) [5]; мониторинг основных жизненно важных показателей (ЭКГ, ЧСС, АД, температура, параметры ИВЛ, газы крови); комплекс клинических критериев для диагностики смерти мозга, разъединительный тест [13]. Интенсивная терапия проводилась по протоколу [3,6,10].
Результаты и обсуждение
Неврологический дефицит у всех наблюдаемых больных по ШКГ составил 3-5 баллов. В дальнейшем из исследования были исключены пациенты, состояние которых улучшилось или оставалось стабильно тяжелым (ШКГ 4-7 баллов и более).
При проведении КТ исследований выявлено, что одной из ведущих причин неблагоприятного исхода критического состояния, обусловленного крайне тяжелой ЧМТ, является нарастание отека-набухания с увеличением зоны отека в 4-6 раз выше эталонных показателей. При этом практически во всех случаях отмечается снижение зоны ликвора ниже эталонных показателей.
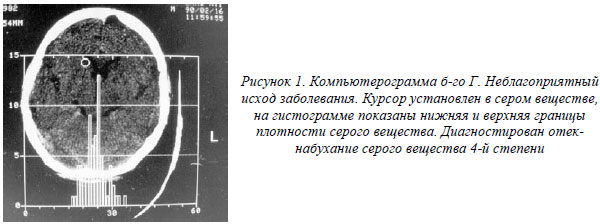
При детализации степени выраженности отека-набухания белого и серого вещества мозга выявлено следующее. При диагностике отека-набухания белого и серого вещества мозга прогностически неблагоприятным является сочетание отека-набухания белого вещества 2-й степени с отеком-набуханием серого вещества 3-й или 4-й степени. В случаях диагностики отека-набухания белого и серого вещества с преимущественным отеком серого вещества мозга прогностически неблагоприятным является наличие отека-набухания серого вещества 3-й или 4-й степени (рис. 1).
Для повышения точности определения неблагоприятного исхода критического состояния, обусловленного крайне тяжелой ЧМТ, предложен способ прогнозирования исхода путем оценки состояния мозгового кровотока за счет проведения серии компьютерных томограмм, измерения плотности вещества мозга до и после внутривенного введения контраста и расчета разности изменения плотности во времени. Отрицательные значения проводимого теста могли служить одним из критериев в постановке диагноза смерти мозга [7].
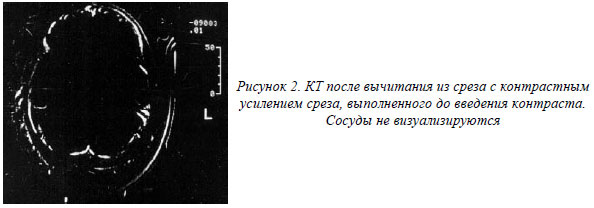
Отсутствие заполнения контрастом мозговых сосудов доказывает прекращение кровотока в мозге, что приводит к лизису нейронов, полной утрате их функции, что и определяет неблагоприятный исход.
Полученные данные можно проиллюстрировать следующими клиническими наблюдениями.
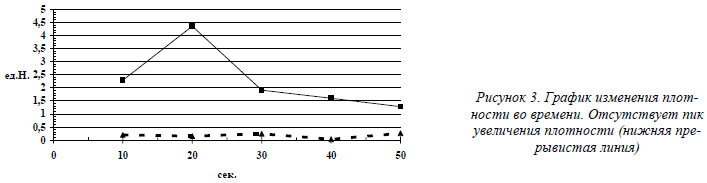
Больная В. 28 лет, поступила в нейрореанимационное отделение с крайне тяжелой ЧМТ в состоянии глубокой комы. Самостоятельное дыхание отсутствовало, проводилась ИВЛ, развилась гипотония, требующая капельной инфузии симпатомиметиков, атония, арефлексия. Учитывая состояние больной, возникло предположение о прекращении мозгового кровообращения. Для подтверждения этого диагноза больной была проведена КТ головного мозга с внутривенным болюсным усилением. Для исследования выбран 5-й срез мозга. В подключичный катетер со скоростью 6 мл/сек. введено 40 мл 20 % раствора верографина. Всего произведено 6 срезов с интервалом 3,5 сек. Все срезы выполнялись на одном уровне, 1-й срез производился до попадания контрастного вещества в сосуды мозга. Измеряли плотность вещества мозга после внутривенного введения контраста, рассчитывали разность изменения плотности во времени. Были получены следующие последовательные изменения плотности во времени: 0,20 ед.Н.; 0,15 ед.Н.; 0,24 ед.Н.; 0,03 ед.Н.; 0,26 ед.Н. Пик увеличения плотности отсутствовал, что свидетельствует об отсутствии мозгового кровотока. Прогноз оценен как неблагоприятный. Несмотря на проводимую терапию, больная умерла (рис. 2,3.).
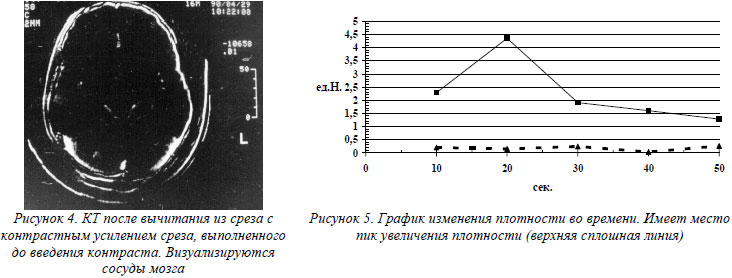
Больной Н. 36 лет, поступил в нейрореанимационное отделение с крайне тяжелой ЧМТ в коматозном состоянии. Самостоятельное дыхание отсутствовало, проводилась ИВЛ, развилась сосудистая гипотония, атония, арефлексия. Учитывая имеющуюся симптоматику, возникло предположение о прекращении мозгового кровообращения. Для подтверждения этого диагноза больному была проведена КТ головного мозга с внутривенным болюсным усилением. Измеряли плотность вещества мозга после внутривенного введения контраста, рассчитывали разность изменения плотности во времени. Были получены следующие последовательные изменения плотности во времени: 2,29 ед.Н.; 4,36 ед.Н.; 1,91 ед.Н.; 1,60 ед.Н.; 1,28 ед.Н. Пик увеличения плотности имел место (4,36 ед.Н.), что свидетельствует о наличии мозгового кровотока. Прогноз оценен благоприятно. Проведение целенаправленной терапии позволило добиться улучшения состояния (рис. 4,5.).
Для контроля за функциональным состоянием ЦНС и диагностики смерти мозга нами использовалась ЭЭГ. Обследовано 23 больных с крайне тяжелой черепно-мозговой травмой. Глубина нарушения сознания по шкале ком Глазго составила 3-4 балла, что соответствовало запредельной коме. Все больные умерли. Изучение уровня фоновой активности ЭЭГ до констатации смерти показало чрезвычайно низкие её значения, свидетельствующие о формировании смерти мозга. Так, ДФН и ДНФН во всех наблюдениях колебалась от 0% до 3,9%, что визуально соответствовало изолинии.
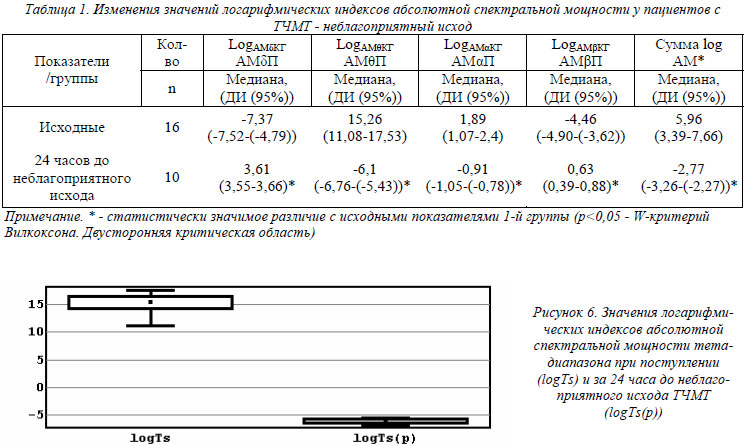
При проведении ЭЭГ-исследования в течение 24 часов до неблагоприятного исхода ТЧМТ у пациентов выявлены значимые изменения значений логарифмических индексов абсолютной спектральной мощности всех исследуемых диапазонов (табл.1). Значительный рост (р<0,05) показателей логарифмических индексов абсолютной спектральной мощности дельта- и бета- диапазонов (табл.1) отражал угнетение данных ЭЭГ- ритмов. Выраженное уменьшение (р<0,05) показателей логарифмических индексов абсолютной спектральной мощности тета- и альфа- диапазонов (рис.6,7) было связано с активацией данных ЭЭГ- ритмов. Причем более выраженное снижение (р<0,05) было характерно для значений LogАМθКГ АМθП, что отражало доминирование активности именно тета- частотного диапазона на ЭЭГ-кривых (табл.1, рис.6).
Наиболее показательным являлось снижение (р<0,05) параметров «суммы логарифмических индексов АМ» до отрицательных значений (табл.1, рис.7), которое свидетельствовало о выраженном «уплощении» ЭЭГ-кривых за счет резкого уменьшении амплитуды практически всех ЭЭГ-ритмов. Таким образом, выраженное снижение показателя «сумма логарифмических индексов АМ» от исходных положительных значений до отрицательных значений является признаком формирования «ЭЭГ-комы». Так называемая электроэнцефалографическая альфа-кома, наблюдаемая у 10 пациентов за 24 часа до неблагоприятного исхода, характеризовалась следующими параметрами: сумма log АМ<0, LogАМαКГ АМαП<0.
Для пациентов с неблагоприятным исходом ТЧМТ (табл.2) при поступлении в отделение наиболее показательными были: снижение (р<0,05) систолической скорости кровотока в бассейнах внутренней сонной артерии (СМА, ПМА) и в вертебробазилярном отделе (ПА и ОА) относительно данных в контрольной группе – здоровые добровольцы. Максимальное замедление (р<0,05) кровенаполнения было типичным для позвоночных артерий, чаще слева, что сопровождалось снижением уровня индекса пульсации за счет роста периферического сопротивления в бассейне данной артерии (табл.2.). Выраженный рост (р<0,05) уровня систолодиастолического соотношения был зафиксирован билатерально в СМА, ПМА и ОА, что отражало значительное снижение диастолического компонента кровотока по данным артериям (табл.2).
Несмотря на проведенную терапию, при исследовании УЗ ТКДГ за 24 часа до неблагоприятного исхода были выявлены следующие особенности:
- снижение (р<0,05) значений систолической скорости кровотока в сосудах бассейна внутренней сонной артерии;
- нарастание (р<0,05) циркуляторного сопротивления во всех лоцируемых артериях, что характеризовалось достоверным увеличением показателей индекса пульсации (PI) билатерально;
- резкое увеличение (р<0,05) значений соотношения S/D за счет снижения диастолической скорости кровенаполнения, вызванного нарушением внутричерепных механизмов регуляции артериальной «подкачки» крови в диастолу.
Диагностика смерти мозга проведена у 7 больных, находящихся в состоянии терминальной комы (ШКГ 3 балла). У всех обследуемых пациентов было исключено влияние лекарственных препаратов, угнетающих ЦНС (седативные, наркозные, наркотические средства, транквилизаторы), и медикаментов, влияющих на нервно-мышечную передачу (миорелаксанты и др.). У всех потенциальных доноров отсутствовали: интоксикация, метаболические нарушения и инфекционные повреждения головного мозга. Температура тела обследуемых составляла 36,2±0,90С, систолическое АД поддерживалось на уровне 110±20 мм рт.ст. с помощью инфузии вазопрессоров (допамин, мезатон). Проводилась ИВЛ респиратором «Бриз» кислородно-воздушной смесью с Fi O2 0,4. Парциальное давление углекислого газа и кислорода составляло соответственно РаCO2 32±2,2 мм рт. ст., РаO2 104±3,75 мм рт.ст., рН 7,42± 0,41. Период наблюдения составлял в среднем 12±2 часа. У 4 пациентов период наблюдения был сокращен до 6 часов после применения подтверждающего теста транскраниальной УЗДГ (отсутствие или инверсия мозгового кровотока). У всех 7 больных в конце периода наблюдения был проведен разъединительный тест. У всех обследуемых пациентов через 15 минут ИВЛ кислородом с Fi О2 1,0 произведено исследование газов крови: РаСО2 29±2,1 мм рт.ст., РаО2 125±8,5 мм рт.ст., рН 7,44±0,62. Затем ИВЛ была отключена и начата инсуффляция кислорода со скоростью 8-10 л/мин. в интубационную трубку. Исследование газового состава крови и рН проводилось каждые 7-10 минут. Через 7 минут РаСО2 составило 40±2,5 мм рт.ст., РаО2 - 139±8 мм рт.ст., рН 7,28±0,08. Через 15±5 минут РаСО2 составило 75±11мм рт.ст., т.е. больше 60 мм рт.ст., РаО2 -200±55 мм рт.ст., рН 7,15±0,06. Самостоятельное дыхание при этом не восстановилось (разъединительный тест положительный), что свидетельствует о необратимом характере структурных и метаболических нарушений деятельности головного мозга. У одного больного через 20 мин. наблюдения РаСО2 составляло 54 мм рт.ст., при этом появились дыхательные движения. Была возобновлена ИВЛ (разъединительный тест отрицательный).
Выводы
Таким образом, нами выработаны следующие критерии прогнозирования исхода критического состояния у пациентов с крайне тяжелой ЧМТ по данным компьютерной томографии, ТКДГ и ЭЭГ.
1. Прогностически неблагоприятным является нарастание отека-набухания с увеличением зоны отека в 4-6 раз выше эталонных показателей, снижение зоны ликвора ниже эталонных показателей.
2. При диагностике отека-набухания белого и серого вещества мозга прогностически неблагоприятным является сочетание отека-набухания белого вещества 2-й степени с отеком-набуханием серого вещества 3-й или 4-й степени. В случаях диагностики отека-набухания белого и серого вещества с преимущественным отеком серого вещества мозга прогностически неблагоприятным является наличие отека-набухания серого вещества 3-й или 4-й степени.
4. Отсутствие заполнения контрастом мозговых сосудов при проведении КТ с внутривенным болюсным усилением, что подтверждается отсутствием изменения плотности мозгового вещества во времени (отсутствие пика увеличения плотности на графике), определяет неблагоприятный исход у пациентов с ОЦН различного генеза (патент N1809757) [7].
5. Выраженное снижение показателя «сумма логарифмических индексов АМ» от исходных положительных значений до отрицательных значений (Сумма log АМ<0) является прогностически неблагоприятным признаком формирования «ЭЭГ-комы».
6. Резкое снижение значений систолической скорости кровотока в сосудах бассейна внутренней сонной артерии, увеличение показателей индекса пульсации (PI) и значений соотношения S/D за счет снижения диастолической скорости кровенаполнения билатерально является неблагоприятным признаком формирования смерти мозга.
7. Вышеуказанный комплекс исследований позволяет выявить прекращение функций головного мозга и установить необратимый характер этого прекращения, что позволяет диагностировать смерть мозга, которая является эквивалентом смерти человека.
- Городник Г.А., Черний В.И., Лазарева Е.В., и соавт. Диагностика смерти мозга у нейрохирургических больных. IV з’їзд нейрохірургів України : Матеріали з’їзду // Дніпропетровськ, 2008. – С. 186.
- Городник Г.А., Черний В.И., Шевченко А.И. Оценка необратимых изменений функции головного мозга при острой церебральной недостаточности в клинике терминальных состояний // Искусственный интеллект (научно-теоретический журнал). – 2000. - № 1. – С. 30-37.
- Ельский В.Н., Кардаш А.М., Городник Г.А. Патофизиология, диагностика и интенсивная терапия тяжелой черепно-мозговой травмы / под редакцией Черния В.И. – Д.: Из-во, 2004. – 200 с.
- Зильбер А.П. Клиническая физиология в анестезиологии и реаниматологии. - М.: Медицина, 1984.-479 с.
- Клиническая допплерография окклюзирующих поражений артерий и конечностей / Учебно-методическое руководство под общей редакцией профессора Е.Б.Куперберга. – Москва.: Издательство НЦССХ им. А.Н.Бакулева РАМН, 1997 – 187с.
- Педаченко Є.Г., Шлапак І.П., Гук А.П., Пилипенко М.М. Черепно-мозкова травма: сучасні принципи невідкладної допомоги: навчал. метод. посіб. / Варта. – К.: 2007. – 311 с.
- Способ прогнозирования постреанимационного периода. Патент № 1809757 от 10 октября 1992 г. Новикова Р.И., Черний В.И., Городник Г.А., Момот Н.В., Соловьева Е.М.
- Черний В.И., Кардаш А.М., Городник Г.А., Дроботько В.Ф. Диагностика и лечение отека и набухания головного мозга. - К.: "Здоров'я", 1997. - 228 с.
- Черній В.І., Шевченко А.І., Городник Г.А. Головний мозок при термінальному стані. – Д.: Наука і освіта, 2000. – 220 с.
- Черний В.И., Кардаш А.М., Городник Г.А., Островая Т.В., Чепига Е.Л., Островой Е.Л., Качанов А.Б. Принципы и методы диагностики и интенсивной терапии тяжелой черепно-мозговой травмы // Методические рекомендации.- Донецк, 2003.- 58 с.
- Черний В.И. Постгипоксическая энцефалопатия. - К.: Здоров’я, 1997. – 336 с.
- Черний В.И., Андронова И.А., Черний Т.В. Оценка эффективности терапии при тяжелой черепно-мозговой травме: метод логарифмических индексов параметров количественной ЭЭГ // Міжнародний неврологічний журнал. - №4(26), 2008. - С.61-70.
- Черний В.И., Ельский В.Н., Городник Г.А., Колесников А.Н. Острая церебральная недостаточность.– Донецк: ООО «ИПП «Промінь», 2007.– 514 с.
- Plum F., Posner J.B. The Diagnosis of Stupor and Coma. Philadelphia: Davis F.A. Company, 1985. - P. 96-100.