Журнал «Травма» Том 11, №4, 2010
Вернуться к номеру
Медико-биологические представления о терапии в процессе регенерации костной ткани препаратами, модулирующими структуру хряща (предварительное сообщение)
Авторы: А.Г. Кушниренко, А.М. Гулай, Е.В. Севериновская - Днепропетровская государственная медицинская академия, Днепропетровский национальный университет им. Олеся Гончара, Днепропетровск, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
В статье рассматриваются предварительные результаты влияния фармакологического (глюкозамина сульфата) и гидродинамического (гидроксиэтил крахмала) факторов на генеративную репарацию поврежденных костей у лабораторных животных.
У статті розглядаються попередні результати впливу фармакологічного (глюкозаміну сульфату) и гідродинамічного (гидроксіетил крахмалу) факторів на генеративну репарацію пошкоджених кісток у лабораторних тварин.
In the article are examined the preliminary results of influencing of pharmacological (glucosaminesulfatis) and hydrodynamic (hidroхyethyl starch) factors on the generative reparation of the damaged bones at laboratory animals.
экспериментальные животные, транскортикальный дырчатый дефект, глюкозамина сульфат, репаративная регенерация, показатели крови
експериментальні тварини, транскортикальний дірчастий дефект, глюкозаміну сульфат, репаративна регенерація, показники крові
experimental animals, transcortical hole defect, glucosaminesulfatis, reparative regeneration, blood indexes
На сегодняшний день частота посттравматических осложнений, связанных с нарушением репаративного остеогенеза, остается достаточно высокой. Положительным моментом является широкое внедрение в практику методов реабилитации пациентов с костно-суставной патологией, но при этом остаются нерешенные вопросы прогнозирования наиболее часто встречающихся осложнений, таких как замедленная консолидация, резорбция, незавершенное сращение костной ткани. Все это побуждает к постоянному поиску средств и способов, положительно влияющих на репарацию поврежденных костей. Основным в лечении любого заболевания является влияние на патогенетические и патофизиологические механизмы, лежащие в основе его развития. В данном случае эффективным является поиск препаратов и комбинированное их применение, способных оказывать структурно-модулирующее влияние и изменять протекание заболевания с учетом возрастных особенностей пациентов.
Целью нашей работы явилось изучение влияния фармакологического (глюкозамина сульфата) и гидродинамического (гидроксиэтил крахмала) факторов на генеративную регенерацию поврежденных костей у лабораторных животных.
Материалы и методы
Исследования выполнены на 56 половозрелых крысах линии Вистар, выращенных в виварии НИИ биологии Харьковского национального университета, двух возрастных групп: молодые (4-5 месяцев в начале эксперимента) крысы массой 180-240 г и старые (13-16 месяцев в начале эксперимента) крысы массой 310-380 г. Все животные содержались на полноценном стандартном рационе вивария. Эксперименты были проведены в соответствии с существующим международными требованиями и нормами гуманного отношения к животным (Конвенция Совета Европы, 1986, Закон Украины от 21.02.2006 г, № 3447-IV).
Эксперимент проводили в течение 6 недель. Первые 2 недели – адаптационный период, когда животные были доставлены в виварий Днепропетровского национального университета имени Олеся Гончара и произвольно помещены в клетки по 3 крысы. Затем животных каждой возрастной группы разделили случайным образом на контрольную (I) группу и опытные группы. Сам эксперимент длился четыре недели.
У животных всех экспериментальных групп под «легкой анестезией» (кетамин - 15 мг/кг) производили дырчатый транскортикальный дефект (диаметром 1 мм) в области средней части бедренной кости левой конечности. В дальнейшем на протяжении 4-х недель (через каждые 3 дня) животным контрольных I и II групп в надколенную область при помощи внутрикостной иглы вводили физиологический раствор, крысам ІІІ и ІV групп при тех же условиях водили глюкозамина сульфат – мг/кг, V и VІ − гидроксиэтил крахмал – мг/кг, VІІ и VІІІ – глюкозамина сульфат + гидроксиэтил крахмал в вышеотмеченных дозах. При этом четные группы составляли молодые животные, нечетные – старые. В конце эксперимента животные подвергались повторному тестированию в открытом поле. Крыс выводили из эксперимента через 4 недели. После их декапитации собирали кровь и, согласно стандартным методикам, определяли: общее количество лейкоцитов и эритроцитов, скорость оседания эритроцитов, количество гемоглобина, осмотическую резистентность эритроцитов (начало гемолиза и полный гемолиз %) по методике Идельсона [4, 3].
Фиксировали параметры возбуждения (реобазу и хронаксию m.quadriceps femoris) на обеих конечностях, нанося электрическое раздражение с помощью электростимуляции [5]. Затем оперированную и интактную конечности отсекали у животных, препарировали m.quadriceps femoris, измеряли ее длину и взвешивали.
Для морфологического исследования отпрепарированную бедренную кость фиксировали в 10% нейтральном формалине, декальцинировали в 12% азотной кислоте, обезвоживали в спиртах восходящей концентрации и пропитывали целлоидином.
Полученные результаты обрабатывали статистически с помощью параметрической статистики.
Результаты и обсуждение
Первоначально для обездвиживания и анестезии животных во время операции нами была выбрана общеизвестная схема (премедикация − тиопентал натрия 50 мг/кг и кетамин 15 мг/кг), применяемая для беспородных лабораторных крыс и которая явилась слишком сильной для крыс линии Вистар. В результате передозировки 6 животным пришлось применить методы реанимации с искусственной вентиляцией легких. Эти методы позволили сохранить жизнь 2 животным, к сожалению, 4 крыс мы потеряли. Поэтому в дальнейшем, нами была применена «легкая анестезия» − кетамин – 15 мг/кг, которая позволила добиться необходимого результата без потери животных. Для ускорения процесса регенерации костной ткани после транскортикального дырчатого дефекта (по общеизвестной методике) применили глюкозамина сульфат. Как известно, соли глюкозамина представляют собой естественные аминомоносахариды глюкозамина с низкой молекулярной массой. Глюкозамин хорошо растворяется в воде и других растворителях, и поэтому легко всасывается и проникает через гематоцелюлярные барьеры тканей. При пероральном применении наибольшее содержание глюкозамина гидрохлорида зафиксировано в печени, почках, легких, суставном хряще [2].
Авторы отмечают, что только 1% введенного таким образом глюкозамина хлорида достигает тканей суставов, в связи с чем терапию этим веществом необходимо проводить в течении длительного периода (3-6 месяцев) до достижения насыщения хряща экзогенным аминосахаридом. Кроме того, отмечен эффект повышения антиоксидантного статуса организма при применении данного препарата.
Результаты наших исследований показали, что за 4 недели эксперимента (по окончании плацебо или препаратов) вес животных несколько изменился (табл.1).
Как и следовало ожидать, вес молодых животных увеличился значительнее, чем старых, что связано с более интенсивными процессами обмена веществ и ростом животных. Интересно, что у молодых крыс, которым вводили глюкозамина сульфат прирост массы в 2,4 раза больше, чем у контрольных животных.
При совместном применении глюкозамина сульфата и гидроксиэтил крахмала наблюдается так же прирост массы животных, но выраженность его несколько ниже, чем при отдельном применении глюкозамина. Интересным выявилось сопоставление массы m.quadriceps femoris, которая травмировалась при проведении операции на экспериментальной конечности с этой же мышцей контралатеральной конечности животных разных групп (табл.2). Отметим, что масса этой мышцы экспериментальной конечности у всех животных была несколько меньшей, чем интактной. Существенное уменьшение мышечной массы может свидетельствовать о болевом синдроме и уменьшении нагрузки на данную мышцу на протяжении некоторого восстановительного периода, что наиболее выражено у контрольных животных.
Если в контроле масса m.quadriceps femoris экспериментальной конечности была на 0,29 г меньше, как у молодых, так и у старых животных, то после применения модулирующих препаратов мы видим более выраженный положительный эффект у молодых животных, особенно в случае применения глюкозамина. Это свидетельствует о протекании активных процессов в мышце оперированной конечности и активном ее использовании при совершении произвольных движений.
Отметим, что длина m.quadriceps femoris в результате проведения экспериментов была практически одинаковой на обеих конечностях у животных всех возрастных и экспериментальных групп, что говорит о стабильности этого показателя.
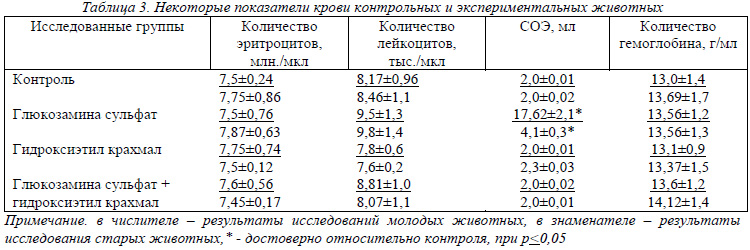
Результаты, исследований крови (табл.3) показали, что количество лейкоцитов в контрольных группах составило 8,17-8,47 тыс./мкл, что соответствует физиологической норме у крыс (8-14 тыс./мкл). Некоторое повышение количества лейкоцитов наблюдалось у животных, которым вводили глюкозамина сульфат, но это повышение лежит в пределах нормальных величин и поэтому оно не вызывает особого беспокойства.
В разновозрастных контрольных группах количество эритроцитов составляло 7,5-7,75 млн./мкл, что находится в пределах нормы для крыс (7,2-9,6 млн./мкл). Этот показатель, несколько колеблясь, достоверно не изменялся у животных экспериментальных групп и так же находился в пределах физиологической нормы. Количество гемоглобина у всех исследованных животных зафиксировано в пределах средних величин −13,0-14,12 г/мл.
Пожалуй, самыми показательными в данной таблице есть величины скорости оседания эритроцитов. У животных, которым вводили глюкозамина сульфат, особенно у молодых наблюдалось резкое увеличение СОЭ до 17 мл. Этот факт требует более детального изучения, в частности изучения лейкоцитарной формулы крови.
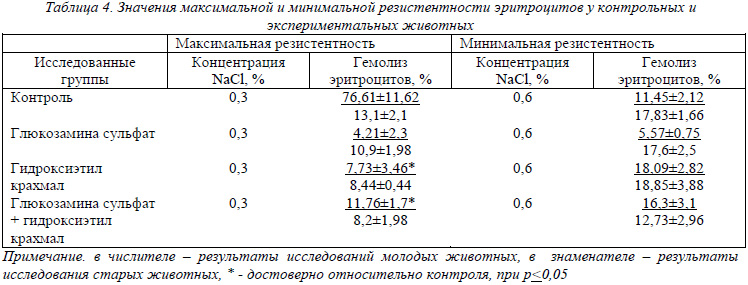
Результаты исследования осмотической устойчивости (резистентности) эритроцитов представлены в табл. 4. У здоровых половозрелых крыс начало гемолиза отмечают при концентрации NaCl 0,6-0,5%, полный гемолиз – при 0,3-0,4%. Наши данные полностью согласуются с общеизвестными. Особо хотелось бы отметить, что у молодых животных, которым для ускорения процесса регенерации костной ткани вводили как отдельно, так и совместно препараты глюкозамина сульфата и гидроксиэтил крахмала процент гемолиза эритроцитов в 0,3% NaCl значительно снижался, что свидетельствует о повышении резистентности красных кровяных клеток, но эти изменения не выходят за пределы нормы. У старых животных эти показатели имеют более стабильные значения, приближенные к контрольным.
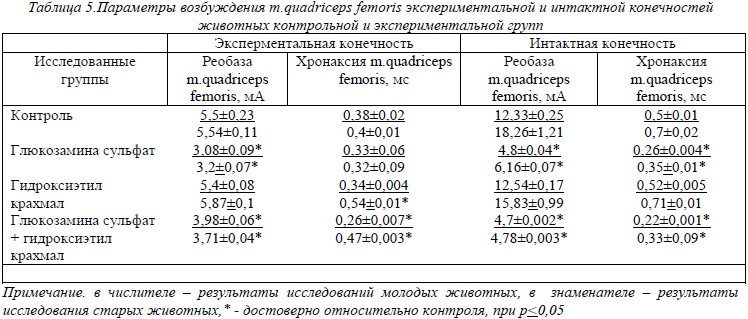
Реобаза и хронаксия дают представление о возбудимости тканей и органов по порогу силы и длительности действия раздражителя. Результаты исследования этих параметров возбудимости на m. quadriceps femoris (табл. 5) показывают, что у молодых контрольных животных средние величины реобазы и хронаксии интактной конечности соответствуют стандартным значениям для мышцы (12,5 мА – реобаза и 0,2-0,7 мс – хронаксия).
У старых животных возбудимость данной мышцы несколько снижена. M. quadriceps femoris оперированной конечности отличается повышенной возбудимостью как у молодых, так и у старых животных. Подобные результаты получены и при введении гидроксиэтил крахмала. При введении соли глюкозамина необходимо меньше силы тока и меньше времени, чтобы вызвать сокращение данной мышцы как интактной конечности, так и экспериментальной, т.о. глюкозамина сульфат способствует повышению чувствительности и активности мышечных волокон.
Общебиологические и медицинские эксперименты на человеке не производятся. Большое количество экспериментальных исследований проводится на некрупных млекопитающих. Часто такими животными являются белые лабораторные крысы. Отсюда возникает необходимость экстраполирования результатов экспериментальных исследований на человека. О.О.Гелашвили предлагает вариант периодизации биологически сходных стадий онтогенеза человека и крысы. По его мнению, один день жизни крысы равен 52 дням жизни человека. Исходя из этого, возраст крыс 5-6 месяцев можно соотнести с репродуктивным возрастом человека 22-32 года, а возраст крыс 14-17 месяцев – с возрастом человека 56-69 лет. Сравнение результатов, полученных для разновозрастных групп, необходимо для эффективного лечения и постоперационной реабилитации больных с заболеваниями суставов и костей с учетом их особенностей. Отметим, что период геронтогенеза (старения) согласно международной классификации начинается с 60 лет у мужчин и с 55 лет у женщин. Он представляет собой генетически запрограммированный процесс, сопровождающийся определенными возрастными изменениями в организме. В период жизни человека после зрелости происходит постепенное ослабление деятельности организма, утрачивается живость тканей организма, что тесно связано с уменьшением в них содержания жидкости. В результате такого обезвоживания суставы пожилых людей подвергаются контрактуре, нередко наблюдается остеопороз костей. В связи с этим возрастает необходимость усиления контроля и регуляции биологических процессов, особенно в постоперационный период.
Наши результаты показали эффективность комплекса примененных препаратов для системы крови, как для молодых животных, так и для старых. Глюкозамина сульфат и гидроксиэтил крахмал позитивно влияют на большинство показателей крови, повышают устойчивость мембран эритроцитов, что позволяет им полностью выполнять свои функции в организме, о чем свидетельствует достаточно стабильные и высокие показатели гемоглобина у всех экспериментальных животных.
Как известно, процессы активного транспорта ионов требуют определенных энергетических затрат, с возрастом же происходит ограничение этих возможностей, что отображается на снижении возбудимости скелетно-мышечных клеток [1]. В миокарде и в скелетных мышцах большое значение приобретают гликолитические процессы и поэтому очень своевременным и результативным есть введение глюкозаминовых препаратов в терапевтических целях, что и показано в данной работе.
Выводы
Проведенные экспериментальные исследования на 56 половозрелых крысах линии Вистар по поводу фармакологического влияния глюкозамина сульфата на репаративную регенерацию поврежденных костей показали высокую эффективность.
- Аршавский И.А. Физиологические механизмы и закономерности индивидуальной чувствительности: основы негентропийной теории онтогенеза. – М.:Наука, 1982.
- Зупанец И.А., Шебеко С.К. Современные хондропротекторы: мифы и реальность // Фармацевтич. практ. – 2008. – С.22-24.
- Идельсон Л.В. Справочник по функциональной диагностике // Под. ред. И.А. Кассирского. – М.: Медицина, 1970. – С. 401.
- Камышников В.С. Справочник по клинико- биохимическим исследованиям и лабораторной диагностике. – М.: МЕДпресс-информ, 2004. – 920с.
- Практикум по физиологии // Под ред. К.М. Кулланды. – М.:Медицина. – 1970. – С.172-174.