Журнал «Травма» Том 10, №2, 2009
Вернуться к номеру
Механизмы влияния мезенхимальных стволовых клеток на репаративный остеогенез
Авторы: В.Г. Климовицкий, В.К.Гринь, В.М.Оксимец, А.Г.Попандопуло, Д.А. Зубов - Донецкий национальный медицинский университет им. М. Горького, Институт неотложной и восстановительной хирургии АМН Украины, Донецк, Институт генетической и регенеративной медицины АМН Украины, Киев, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
В статье представлены данные экспериментальных исследований in vitro. Показано, что некоммитированные МСК экспрессируют на своих мембранах СD44high/СD166high/СD58+/CD62L+/CD29+/CD49b+/CD49c+/CD56+/CD54+, а коммитированные по остеогенному типу клетки – СD44high/СD166high/ СD58+/CD62L+/ CD29+/CD49b+/ CD49c+/ CD54+/CD56-/lo/HLA-DR/lo. Наряду с экспрессией этих кластеров дифференцирования как некоммитированные, так и коммитированые по остеогенному типу МСК активно продуцируют цитокины – ИЛ-1β, ИЛ-2, ИЛ-6, ИЛ-8, ФНП-α и ИЛ-4. Изменения активности рецепторного аппарата и уровня продукции цитокинов в процессе пролиферации и дифференцировки позволяют создать условия, необходимые для течения процессов репаративного остеогенеза.
У статті представлені дані експериментальних досліджень іn vіtro. Показано, що некомітовані МСК експресують на своїх мем-бранах СD44hіgh/СD166hіgh/СD58+/CD62L+/CD29+/ CD49b+/CD49c+/CD56+/CD54+, а комітовані за остеогенним типом кліти-ни - СD44hіgh/СD166hіgh/СD58+/CD62L+/CD29+/CD49b+/CD49c+/CD54+/CD56-/lo/HLA-DR/lo. Разом з експресією цих кластерів диференціювання як некомітовані, так і комітовані за остеогенним типом МСК активно продукують цитокіни - ІЛ-1β, ІЛ-2, ІЛ-6, ІЛ-8, ФНП- α й ІЛ-4. Зміни активності рецепторного апарату й рівня продукції цитокінів у процесі проліферації й диференційовки дозволяють створити умови, необхідні для перебігу процесів репаративного остеогенезу.
The article presents the results of experimental research in vitro. It was showed that uncommitted mesenchymal stem cells expres СD44high/СD166high/СD58+/CD62L+/CD29+/ CD49b+/CD49c+/CD56+/CD54+, and osteogenic inducted cells - СD44high/СD166high/СD58+/CD62L+/CD29+/ CD49b+/CD49c+/CD54+/CD56-/lo/HLA-DR/lo. Both mesenchymal stem cells secreted the cytokines of IL-1β, IL-2, IL-4, IL-6, IL-8 and TNF-α. Modification of the receptors of cell’s memdran and the activity of the cytokine profile during of proliferation and differation mesenchymal stem cells create necessary conditions for the repair osteogeneses.
некоммитированные и коммитированные мезенхимальные стволовые клетки, остеогенный путь, фенотип, продукция цитокинов, остеогенез, ремоделирование костной ткани
некомітовані й комітовані мезенхімальні стовбурові клітини, остеогенный шлях, фенотип, продукція цитокінів, остеогенез, ремоделювання кісткової тканини
uncommitted and osteogenic inducted mesenchymal stem, cell surface antigens, cytokines, osteogeneses, bone resorption, bone reparation
Изучению остеогенного потенциала мезенхимальных стволовых клеток (МСК) в последнее время уделяется значительное внимание. В большом количестве экспериментальных работ убедительно показано, что при определенных условиях МСК начинают формировать остеоноподобные структуры [44, 56-58, 60, 68]. В ряде работ показана клиническая эффективность МСК в восстановлении остеорепаративных процессов [5, 16, 25, 27, 43]. Но несмотря на значительное количество публикаций, в доступной литературе нам не удалось найти работ, посвященных изучению механизмов влияния МСК на процессы репаративного остеогенеза. Хорошо известно, что клетка как самостоятельная биологическая единица осуществляет свое воздействие на окружающие ее клетки и сама находится под воздействием окружающих клеток. Реализация таких межклеточных взаимодействий осуществляется за счет рецепторов, имеющихся на поверхности клеточной мембраны и продуцируемых клетками факторов роста и цитокинов [17,18,26,52,53,61,62].
В связи с этим целью наших исследований было изучение рецепторного аппарата и цитокиновой продукции некоммитированных и коммитированных по остеогенному пути МСК как факторов, реализующих влияние МСК на процессы репаративного остеогенеза.
Материал и методы
В экспериментах in vitro при помощи иммуннофенотипирования изучали модификацию рецепторного аппарата и, используя иммуноферментный метод BD OptEIA Human ELISA, определяли продукцию цитокинов некоммитированными и коммитированными по остеогенному типу МСК. В исследованиях использовали МКА, которые рекомендованы для специфического маркирования поверхностных антигенов 8-ым Международным рабочим совещанием по вопросам лейкоцитарных антигенов дифференцирования человека (The 8th International HLDA Workshop and Conference, Adelaide, Australia, 2004). Все МКА и изотип-контроли были производства фирмы BD Biosciences (США). Определение концентрации цитокинов в супернатантах культивированных МСК проводили при помощи иммуноферментного метода BD OptEIA™ Human ELISA (производства – BD Biosciences, США), которые предназначены для количественного определения цитокинов человека в сыворотке, плазме и в супернатанте (кондицированной среде) клеточных культур. Использовали наборы для определения следующих цитокинов: human ІL-1β ELISA Kit II; human ІL-2 ELISA Kit II; human ІL-4 ELISA Kit II; human ІL-6 ELISA Kit II; human ІL-8 ELISA Kit II; human TNF ELISA Kit II. Маркирование некоммитированных и остеоиндуцированых МСК на поверхностные антигены осуществляли в культурах 1-4-го пассажей от 14 линий, а концентрацию ЦК в супернатантах на 1-е, 3-и и 5-е сут. для неиндуцированных МСК и на 10-е, 13-е, 16-е и 19-е сутки для индуцированных клеток.
Результаты и обсуждение
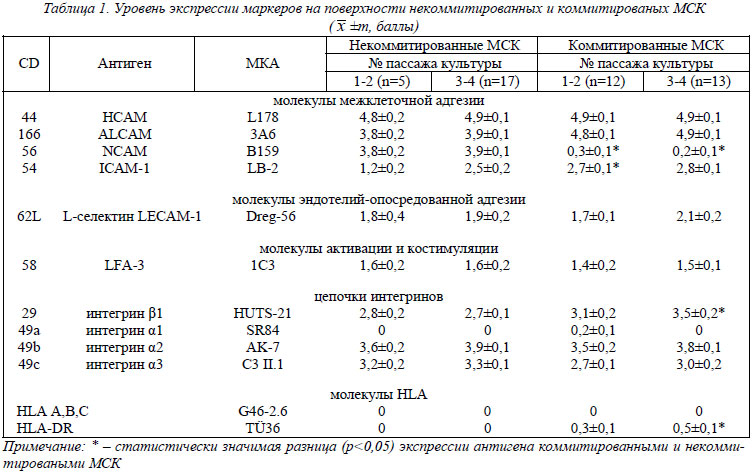
Фенотип (рецепторный аппарат) некоммитированных и коммитированных по остеогенному пути МСК костного мозга. В связи с тем что в процессе исследований было использовано значительное количество маркеров, полученные данные, для упрощения их анализа, были сгруппированы по антигенам, обладающим подобными функциями: а) адгезивные молекулы межклеточного взаимодействия; б) молекулы адгезии к эндотелиальным клетками и адгезивные молекулы эндотелиоцитов; в) молекулы, обеспечивающие адгезию к внеклеточному матриксу (ВКМ); г) молекулы, ответственные за активацию и костимуляцию иммуннокомпетентных клеток; д) молекулы, определяющие основной комплекс гистосовместимости (Major Hіstocompatіbіlіty Complex (МНС)). Данные исследований представлены в таблице 1.
Из группы антигенов межклеточной адгезии на поверхности некоммитированных и коммитированных по остеогенному пути МСК были выявлены СD44, CD166, CD56 и CD54. Из представленных в таблице данных видно, что уровень экспрессии СD44 и CD166 является достаточно высоким (>95% и >76% соответственно) как у некоммитированых, так и у коммитированных МСК. Экспрессия антигена CD56 на поверхности некоммитированных и коммитированных МСК была достоверно различна (p<0,05). Уровень его экспрессии в некоммитированных линиях был почти 75%, а в коммитированных снижался практически до нуля. Экспрессия CD54 находилась на среднем уровне в обеих группах МСК. Однако в первых двух пассажах клеток двух групп наблюдалось статистически значимое увеличение уровня экспрессии CD54 у коммитированных МСК (p<0,05).
Среди группы рецепторов-молекул клеточной адгезии, которые определяют межклеточные взаимодействия в системе «активированный/неактивированный эндотелий – клетка», позитивная экспрессия на поверхности МСК была получена для L-селектина – CD62L. Уровень экспрессии в обеих группах клеток был незначительным (до 40 %) и не имел статистически значимых различий.
В группе маркеров, сформированных на основе их возможности принимать участие в процессах прямой и опосредованной активации иммуннокомпетентных клеток и других клеточных популяций (антигены активации и костимуляции), отмечалась незначительная экспрессия LFA-3 (СD58). Данный антиген экспрессировался как некоммитированными, так и коммитироваными МСК.
Из антигенов молекул, которые вовлекаются в межклеточную и клеточно-матриксную адгезию, на клетках культур обеих групп МСК экспрессировались β1(СD29), α2 (СD49b) и α3 (СD49с) субъединицы интегринов. Сформированные ими рецепторы позволяют клеткам присоединяться к молекулам внеклеточного матрикса, таким как фибронектин, ламинин и коллаген. Интегрин β1 был представлен на большинстве клеток культур, а в группе коммитированных МСК 3-4 пассажей наблюдалось достоверное увеличение его экспрессии (p<0,05). Субъединицы интегринов α2 и α3 также отчетливо визуализировались на клеточной мембране приблизительно в одинаковом балльном интервале (около 60% СD-позитивных клеток культур в обеих группах МСК). На основании рангового анализа экспрессия интегриновых субъединиц (β1, α2 и α3) может считаться стабильной в течение всего периода культивирования. В связи с тем что комбинации β1- и разных α-цепочек формируют рецепторы к компонентам экстрацеллюлярного матрикса (α2β1-ламинин, коллаген и α3β1-ламинин, коллаген, фибронектин), то полученные данные позволяют говорить о наличии на МСК полноценных рецепторов к большинству компонентов соединительной ткани. Экспрессия интегриновой α1-цепочки, субъединицы коллагенового рецептора полностью отсутствовала на обеих группах МСК.
При выявлении на поверхности культивированных МСК антигенов Мнс-комплекса было установлено, что в процессе культивирования моноклональные антитела практически не выявляют молекулы I класса – HLA-A,B,C и ІІ класса – HLA-DR. Незначительный уровень экспрессии HLA-DR отмечался в культурах коммитированных МСК. Известно, что МСК экспрессируют поверхностные молекулы ІІ класса HLA-DR только при стимуляции их γ-интерфероном. Отсутствие экспрессии данного класса МНС является одним из критериев, идентифицирующих МСК в нестимулированном состоянии [54].
Основываясь на представленных выше результатах исследований, некоммитированные культивированные МСК, в соответствии с использованной панелью маркеров, имеют следующий рецепторный аппарат (фенотип): СD44high/СD166high/СD58+/CD62L+/CD29+/CD49b+/CD49c+/CD54+/CD56+,а культивированные коммитированные по остеогенному пути МСК
СD44high/СD166high/СD58+/CD62L+/CD29+/CD49b+/CD49c+/CD54+/CD56-/lo/ HLA-DR-/lo.
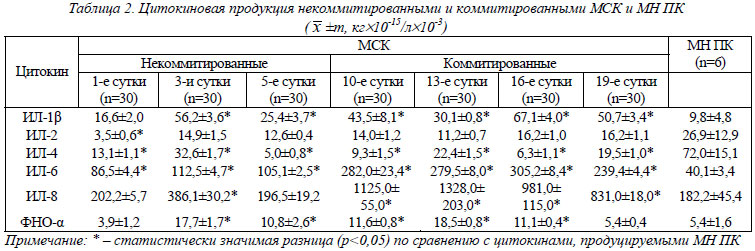
Цитокиновая продукция некоммитированными и коммитированными культурами МСК костного мозга. Данные, полученные в результате изучения продукции цитокинов некоммитированными и коммитироваными МСК, представлены в таблице 2. Для оценки активности цитокиновой продукции некоммитированными и коммитированными МСК в таблицу были включены данные о цитокиновой продукции нестимулированными клеточными культурами мононуклеаров периферической крови (МН ПК) здоровых доноров, которые были получены в результате мета-анализа зарубежных исследований [29-34].
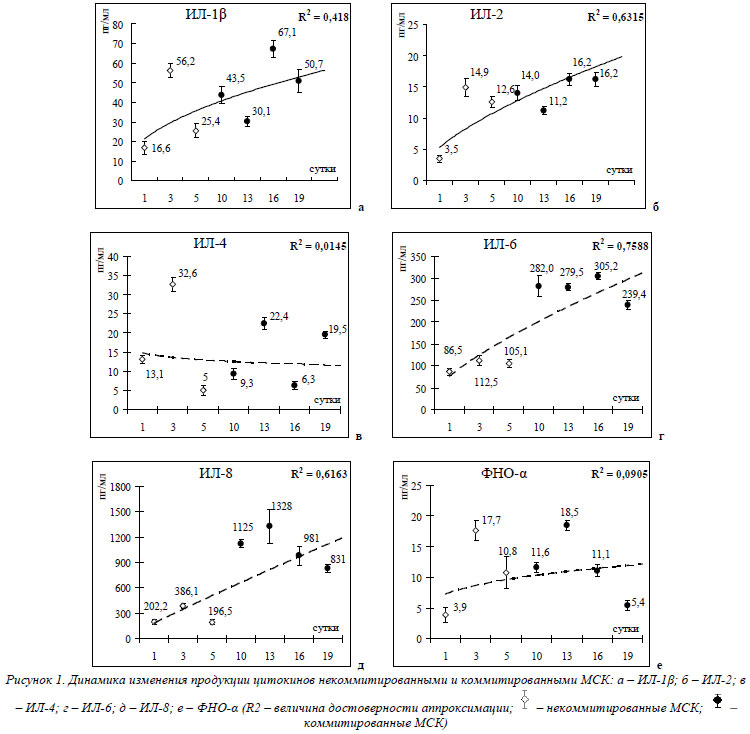
Из представленных в таблице 2 данных видно, что некоммитированные и коммитированные МСК секретируют ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8 и ФНО-α. Хотелось бы подчеркнуть, что продукция ИЛ-1β и ИЛ-2 культивированными МСК нами была выявлена впервые. Для анализа динамики секреции ЦК МСК в процессе их пролиффереции (некоммитированные МСК) и дифференцировки (коммитированные по остеогенному пути МСК) цифровой материал таблицы 2 был представлен в виде графиков с их аппроксимацией и определением величины достоверности аппроксимации R2 (рис. 1).
Из представленных на рисунке 1 графиков видно, что в процессе коммитации МСК отмечалось достоверное увеличение секреции ИЛ-2 (R2»0,63), ИЛ-6 (R2»0,76) и ИЛ-8 (R2»0,62) по сравнению с некоммитированными клетками. Продукция ИЛ-4 и ФНП-α как некоммитироваными, так и коммитироваными МСК оставалась практически на одном уровне (R2»0,015 и R2»0,091 соответственно), а продукция ИЛ-1β имела отчетливую тенденцию к увеличению (R2»0,42). Рост уровня секреции ИЛ-6 и ИЛ-8 культивированными МСК, особенно коммитированными по остеогенному типу, в нашем исследовании выявлен впервые.
При сравнении цитокиновой продукции МСК с МН ПК (см. табл. 2) было отмечено, что продукция ИЛ-1β, ИЛ-4, ИЛ-6, ИЛ-8 и ФНО-α некоммитированными и коммитированными МСК в процессе культивирования достоверно отличалась от таковой у МН ПК (p<0,05) за исключением продукции ИЛ-1β, ИЛ-8 и ФНО-α в течение первых суток культивирования, когда их концентрация не отличалась от цитокиновой продукции МН ПК. Секреция МСК ИЛ-2 была достоверно ниже (p<0,05) только в первые сутки культивирования. В течение последующего времени культивирования достоверного различия между секрецией ИЛ-2 МСК и МН ПК отмечено не было.
Таким образом, некоммитированные и коммитированные по остеогенному пути МСК в условиях культуры активно продуцируют про- и противовоспалительные ЦК – ИЛ-1β, ИЛ-2, ИЛ-6, ИЛ-8, ФНП-α и ИЛ-4 соответственно. Впервые выявлена секреция ИЛ-1β и ИЛ-2 культивированными МСК, а также впервые было выявлено увеличениt уровня секреции ИЛ-6 и ИЛ-8 культивированными МСК, в частности в коммитированной группе. Полученные в результате исследований данные о модификации поверхностных рецепторов и цитокиновой продукции у некоммитированных и коммитированных МСК позволяют определить функциональные возможности этих клеток и механизмы их влияния на процессы репаративного остеогенеза.
Наиболее выраженная экспрессия мембранных антигенов на поверхности как некоммитированных, так и коммитированных МСК человека наблюдалось у СD44 и СD166.
В зависимости от клеточной популяции CD44 может выполнять различные функции, основными из которых являются клеточная адгезия, хоуминг клеток в периферические лимфоидные органы и очаги воспаления, клеточная активация и увеличение продукции цитокинов и факторов роста. В экспериментах было показано, что при повреждении тканей для формирования грануляционной ткани необходима миграция фибробластов в рану, которая обеспечивается активацией интегриновых рецепторов и протеогликановым комплексом, образующийся за счет дерматан-, хондроитин-сульфата и изоформы СD44Н [24]. В исследованиях H.N.Lovvorn at al. было показано, что заживление постнатальных покровных тканей с высоким уровнем экспрессии CD44 происходит без формирования рубца [35].
Основной функцией CD166, наиболее детально изученной на сегодняшний день, является активация клеток иммунной системы и инициация межклеточных взаимодействий, в том числе взаимодействие эпителиальных клеток с лимфоцитами [22, 65].
В отличие от CD44, у которого уровень активности отмечался очень высоким как у некоммитированных, так и у коммитированных МСК, у СD166 он увеличивался с высокого у некоммитированых клеток до очень высокого у коммитированных. Последнее, возможно, связано с тем, что клетки иммунной системы играют важную роль при формировании остеоидной ткани [1, 6, 7]. Повышение уровня активности данного кластера при дифференцировке МСК по остеогенному пути обеспечивает необходимую активацию клеток иммунной системы.
CD56 является биологически важной молекулой для функционирования остеобластов и МСК. Этот рецептор принимает активное участвует в литических процессах в костной ткани [20]. В ряде исследований было показано, что NCAM (антиген к CD56) активно экспрессируется остеобластами, клетками периоста и МСК в зонах активного формирования кости, при этом он не экспрессируется остеоцитами [23]. Поэтому активность экспрессии CD56 достоверно (p<0,05) снижается в процессе остеогенной дифференцировки МСК.
Основной функцией CD54 является активация Т-, В-лимфоцитов, моноцитов и эндотелиальных клеток [28,59,70]. В процессе пролиферации МСК экспрессия этого кластера была на стабильно среднем уровне. Однако уже в начале процесса дифференцировки происходило достоверное увеличение уровня его экспрессии (p<0,05), что, возможно, связано с тем, что данный антиген вовлекается в процессы васкуляризации и вовлечения предшественников остеокластов – моноцитов – в область резорбции костной ткани при заживлении костной раны. Также CD54 выполняет определенную иммуннорегуляторную функцию в стадии воспаления остеорепаративного процесса. СD62L, активность которого была значительной в двух группах МСК, действует как хоуминговый рецептор для лейкоцитов и способствует их адгезии к активированному эндотелию венул [55].
CD58, известный как один из основных антигенов, которые определяют функциональную активность лимфоцитов (LFA-3), обеспечивает костимуляционный сигнал в иммунном ответе, активирует киллерные клетки и обеспечивает их адгезию к клеткам-мишеням [21,47]. Также экспрессия CD58 на клеточной поверхности определяет роль данной клетки в межклеточных взаимодействиях при воспалительном процессе [64]. Миграция и активация тромбоцитов, инвазия фибробластов, лимфоидных и эпителиальных клеток в процессе заживления раны осуществляется путем интегриново-матриксных взаимодействий [13,15]. Экспрессия различных цепочек интегринов на МСК свидетельствует о том, что эти клетки принимают активное участие в репаративных процессах.
Недавно было показано, что протеины внеклеточного матрикса кости – коллаген I типа и витронектин – индуцируют остеогенную дифференциацию. Это свидетельствует в пользу того, что протеины костного матрикса и связанные с ними интегриновые рецепторы, в том числе CD29, участвуют в остеогенной дифференциации МСК [63] CD 49b (α2β1-інтегрин), являясь рецептором к коллагену и ламинину, регулируют экспрессию коллагена І типа и коллагеназы-3, которая необходима для клеточной миграции на коллагене [40]. Одной из функций ламининового (ЛН-5) рецептора (CD 49с, α3β1) является активация остеогенных генов с помощью транскрипционого фактора Runx2/CBFA-1 [10,45]. Значительная активность экспрессии различных цепочек интегринов как на некоммитированных, так и коммитированых МСК свидетельствует в пользу готовности культивированных популяций МСК к активному остеогенезу при их трансплантации.
Таким образом, модификация рецепторного аппарата МСК в процессе пролиферации и дифференцировки создает микроокружение, которое активизирует клетки иммунной системы, эндотелиоциты, преостеокласты, тромбоциты, фибробласты и остеогенные транскрипционные факторы. В зависимости от клеточной стадии, в которой находятся МСК (пролиферации или дифференцировки), активность ряда рецепторов клеточной мембраны изменяется. В стадии пролиферации активность экспрессии CD56 и CD58 выше, чем в стадии дифференцировки и, наоборот, в стадии дифференцировки возрастает активность CD166, CD54, CD62L и CD29, что позволяет создать условия для формирования из МСК костной ткани de novo.
Являясь одним из основных регуляторов иммунного и воспалительного ответа, интерлейкин 1β действует практически на все типы клеток. Основными свойствами ИЛ-1 являются активация: продукции антител В-лимфоцитами; выработки разными клетками факторов колонизации (гранулоцитарного колониестимулирующего фактора (Г-КСФ), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), макрофагального колониестимулирующего фактора (М-КСФ); образования нейтрофилов и моноцитов; резорбция и перестройка кости; пролиферация фибробластов и синовиоцитов. Влияя на эндотелий, ИЛ-1 увеличивает его проницаемость, индуцирует его прокоагуляционную активность, стимулирует выделение фактора активации тромбоцитов (PAF), а также усиливает прилипание лимфоцитов и нейтрофилов к эндотелиоцитам [19]. В экспериментах in vitro было показано, что ИЛ-1 обладает супрессивным эффектом на хондрогенез и матриксные протеины кости КМБ-2 и КМБ-9 [50]. Также ИЛ-1 способствует увеличению экспрессии генов матрикс-разрушающих энзимов (ММП-3 и 13), снижению экспрессии матриксных генов коллагена І и ІІ типа [46] и индуцирует резорбцию костной ткани за счет стимуляции продукции остеокластоподобных многоядерных клеток и увеличения остеолитической активности остеокластов [11]. Достоверное увеличение продукции ІЛ-1β МСК в процессе их пролиферации и дифференцировки свидетельствует о том, что МСК посредством продукции этого цитокина способствуют развитию в области трансплантации воспалительного процесса и активизации процессов остеорезорбции. Наличие отчетливой тенденции к увеличению секреции ИЛ-1β в процессе пролиферации и дифференцировки, вероятно, направлено на привлечение в зону трансплантации преостеокластов – моноцитарных клеток, наличие которых, согласно теории сопряжения функции остеокластов и остеобластов (взаимного потенцирования дифференцировки и активации друг друга), необходимо для формирования костной ткани [3, 4]. Действие интерлейкина 2 на находящиеся в покое клетки проявляется в активации их пролиферации, что определяет его как типичный фактор роста клеток лимфо-миелоидного ряда и негемопоэтических клеток [69]. Мишенями регуляторного воздействия ИЛ-2 являются различные субпопуляции Т- и В-клеток, натуральные киллерные клетки и макрофаги [9]. Основными процессами, которые стимулирует этот ЦК, являются: пролиферация и дифференциация Т- и В-лимфоцитов, активация и пролиферация натуральных киллерных клеток и макрофагов и усиление синтеза иммуноглобулинов и интерферона [69].
В процессе пролиферции и дифференцировки МСК секреция ИЛ-2 достоверно возрастала, что свидетельствует о регуляторном влиянии МСК на клеточный и гуморальный иммунитет, играющий важную роль в остеорепаративных процессах [1,2,8]. Интерлейкин-4 принимает участие в развитии костномозговых клеток-предшественников [41], стимулирует пролиферацию Т-лимфоцитов и фибробластов, участвует в дифференцировке В-лимфоцитов, тормозит выделение моноцитами и макрофагами провоспалительных ЦК – ТФР-α и ИЛ-1 [41,49], играет важную роль в регуляции гомеостаза костной ткани, угнетая RANKL-индуцированную костную резорбцию и активность зрелых остеокластов человека [51]. Секреция ИЛ-4 МСК в процессе пролиферации и дифференцировки достоверно не менялась, отмечались периоды его достоверного увеличения, что, вероятно, связано с увеличением пролиферативной активности клеток и их дифференцировкой.
Интерлейкин-6 является одним из основных факторов регуляции защитных механизмов и принимает участие в иммунном ответе, воспалительной реакции и гемопоэзе. Он индуцирует B-клеточное дифференцирование, стимулирует секрецию IgG, усиливает пролиферацию коммитированных предшественников гранулоцитарной и макрофагальной клеточных линий, стимулирует клетки-предшественники костного мозга и стимулирует резорбцию кости остеокластами [42, 36-39]. Достоверная динамика увеличения секреции ИЛ-6, вероятно, обусловлена тем, что в процессе дифференцировки в остеобласты МСК посредством продукции ИЛ-6 регулируют процессы подготовки резорбционной лакуны к прикреплению остеобласта. Интерлейкин-8 продуцируется мононуклеарными фагоцитами, полиморфно-ядерными лейкоцитами, эндотелиальными клетками, макрофагами, лимфоцитами, эпителиальными клетками, фибробластими, клетками эпидермиса [37,66]. Обладая выраженными провоспалительными свойствами, он выступает как хемоаттрактант для нейтрофилов, макрофагов, лимфоцитов, эозинофилов и способствует их адгезии. Эти свойства определяют его как активного участника острой воспалительной реакции в области патологического процесса [12,37,67].
Уровень секреции ИЛ-8 в процессе пролиферации и дифференцировки МСК достоверно возрастал. Причем наиболее высокая продукция этого ЦК отмечалась при коммитации (дифференцировке) МСК по остеогенному типу. Такое увеличение продукции ИЛ-8 во время дифференцировки клеток, вероятно, связан с привлечением в область трансплантации МСК значительного количества макрофагов и мононуклеарных клеток для образования остеокластов, резорбции поврежденной костной ткани, элиминации нежизнеспособных тканей и подготовки места для прикрепления преостеобластов и их последующей дифференцировки.
Фактор некроза опухоли - альфа. Рецепторы для этого ЦК имеются практически на всех клетках, содержащих ядро. Сигналы, передающиеся через ФНО-рецепторы, активируют А- и С-киназы и транскрипционные факторы NF-AT, NF-κB и AP-1 [14]. Биологическая активность ФНО-α состоит в цитотоксичности относительно некоторых опухолевых клеток, активации гранулоцитов, макрофагов, эндотелиальных клеток (инициирует ангиогенез), остеокластов и хондроцитов (резорбция костной и хрящевой тканей), стимуляции пролиферации и дифференцировки нейтрофилив, фибробластив, Т- и В-лимфоцитов. Этот ЦК принимает участие не только в защитных реакциях, но и процессах деструкции и репарации, служит медиатором деструкции тканей при длительных хронических патологических процессах [48]. Уровень секреции ФНО-α в процессе пролиферации и дифференцировки МСК достоверно не изменялся, имело место незначительное колебание этого ЦК во времени. Продукция ФНО-α в процессе пролиферации и дифференцировки МСК, так же как и ряда других ЦК, вероятнее всего, направлена на активацию воспаления, макрофагальных клеток и клеток остеокластического дифферона.
Таким образом, секреция цитокинов в процессе пролиферации и дифференцировки МСК направлена на формирование воспаления в области трансплантации МСК, инициацию ангиогенеза, резорбцию костной ткани и образования на ее месте новой костной ткани из дифференцирующихся по остеогенному пути МСК.
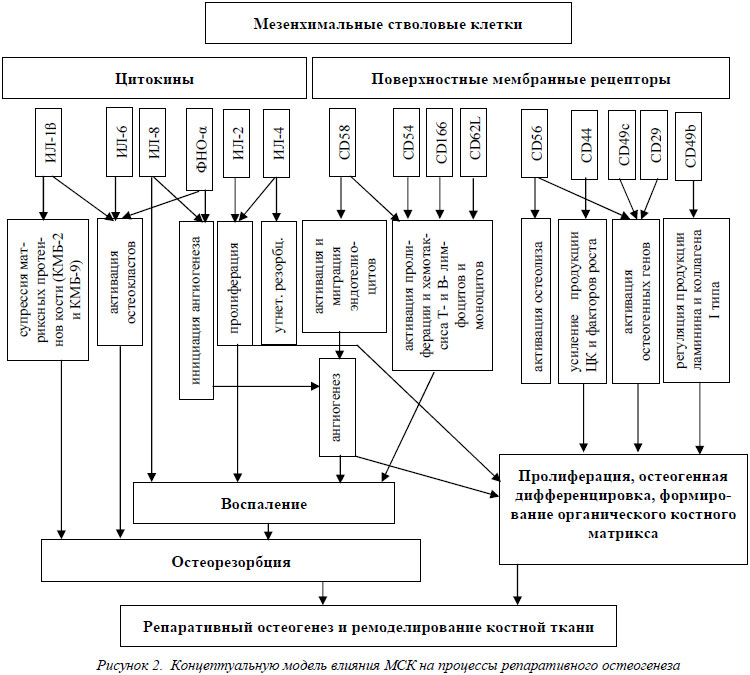
Основываясь на полученных в результате исследований данных о модификации рецепторного аппарата клеточной мембраны и продукции цитоктнов мезенхимальными стволовыми клетками в процессе их пролиферации и дифференцировки, нами была создана блок-схема, представляющая концептуальную модель механизмов влияния МСК на процессы репаративного остеогенеза (рис. 2).
Выводы
Таким образом, представленные в настоящей статье экспериментальные данные свидетельствуют о том, что некоммитированные МСК экспрессируют на своих мембранах СD44high/СD166high/СD58+/CD62L+/CD29+/ CD49b+/CD49c+/CD56+/CD54+, а коммитированные по остеогенному типу клетки – СD44high/СD166high/СD58+/CD62L+/CD29+/ CD49b+/CD49c+/CD54+/CD56-/lo/HLA-DR/lo. Наряду с экспрессией этих кластеров дифференцирования как некоммитированные, так и коммитированые по остеогенному типу МСК в процессе культивирования активно продуцируют цитокины – ИЛ-1β, ИЛ-2, ИЛ-6, ИЛ-8, ФНП-α и ИЛ-4. Изменения активности рецепторного аппарата и уровня продукции цитокинов в процессе пролиферации и дифференцировки позволяют создать условия, необходимые для течения процессов репаративного остеогенеза.
- Астахова В.С. Принципи імунокоригуючої терапії хворих на остеомієліт // Посібник з актуальних проблем кістковогнійної хірургії та методів консервативного лікування. – 2-е видання. – К., 1999. – С. 358-372.
- Бабаева А.Г. Иммунология восстановительных процессов // Современные проблемы регенерации.–Йошкар-Ола.–1982.–С.44-51.
- Быков В.Л. Цитология и общая гистология (функциональная морфология клеток и тканей человека).–СПб.: СОТИС, 2002.– 520 с.
- Докторов А. А., Пак Гван Чор Морфофункциональная характеристика эндоста в связи с проблемой ремоделирования кости // Архив патологии. – 1998. – Том 60, № 5. – С. 19-23.
- Казаков В.Н., Климовицкий В.Г., Гринь В.К., Пастернак В.Н., Оксимец В.М., Попандопуло А.Г., Верещагин С.И, Зубов Д.А. Трансплантация аутологичных стромальных стволовых клеток как метод восстановления клеточных источников репарации (пилотные исследования) //Травма.– 2006. – Том 7, № 3. – С. 368-377.
- Корж А.А., Белоус А.М., Панков Е.Я. Репаративная регенерация кости / АМН СССР. – М.: Медицина, 1972.– 232 с.
- Лаврищева Г.И., Оноприенко Г.А. Морфологические и клинические аспекты репаративной регенерации опорных органов и тканей. – М.: Медицина, 1996. – 208 с.
- Ревенко Т.А., Cеренкова М.Г., Гаврилов И.И., Колосова Т.А. Посттравматический остеомиелит длинных костей как осложнение открытых переломов // Протезно-ортопедическая помощь больным с остеомиелитом и его последствиями. – Киев. – 1985. – С.53-55.
- A biophysical approach to IL-2 and IL-15 receptor function: localization, conformation and interactions / A. Bodnár, E. Nizsalóczki, G. Mocsár [et al.] //Immunol. Lett. – 2008. –Vol.116, № 2. – P.117–125.
- A novel link between integrins, transmembrane-4 superfamily proteins (CD63 and CD81), and phosphatidylinositol 4-kinase / F. Berditchevski, K. Tolias, K. Wong [et al.] // J. Biol. Chem. – 1997. – Vol. 272. – P. 2595–2598.
- Autocrine regulation of osteoclast formation and bone resorption by IL-1 alpha and TNF alpha / N. Tani-Ishii, A. Tsunoda, T. Teranaka [et al.]// J. Dent. Res. – 1999. – Vol. 78. – P. 1617–1623.
- Baggiolini M. Interleukin-8, a chemotactic and inflammatory cytokine / M. Baggiolini, I. Clark-Lewis // FEBS Lett. – 1992. – Vol. 307, № 1. – P. 97–101.
- Cassiman J. J. The involvement of the cell matrix receptors, or VLA integrins, in the morphogenetic behavior of normal and malignant cells is gradually being uncovered / Cassiman J. J. // Cancer Genet. Cytogenet. – 1989. – Vol. 41, № 1. – P. 19–32.
- Chen G. TNF-R1 signaling : a beautiful pathway / G. Chen, D. V. Goeddel // Science.–2002.–Vol.296,№5573.–P. 1634–1635.
- Choma D. P. Integrin α3ß1 directs the stabilization of a polarized lamellipodium in epithelial cells through activation of Rac1 / D. P. Choma, K. Pumiglia, C. M. Di Persio // J. Cell Science. – 2004. – Vol. 117. – P. 3947–3959.
- Connolly J.F. Clinical use of marrow osteoprogenitor cells to stimulate osteogenesis//Clin. Orthop. Relat.Res.–1998.– N 355, Suppl. – P. S257- 266.
- De Vernejoul M. C. Cellules osseuses et remodelage osseux / M. C. De Vernejoul, P. J. Marie // Madadies métaboliques osseuses de l’adulte. – Paris : Flammarion, 1996. – P. 3–16.
- De Vernejoul M. C. Estrogènes et tissu osseux / M. C. De Vernejoul, P. J. Marie// Med. Ther. –2001.–Vol.2,№ 1.– P. 29–33.
- Dinarello C. A. The interleukin-1 family : 10 years of discovery / C. A. Dinarello//FASEB J.–1994.–Vol.8,№15.–P.1314–1325.
- Ely S. A. Undetermined significance and lymphomas with plasmacytoid differentiation / S. A. Ely, D. M. Knowles // Am. J. Path. – 2002. – Vol. 160, № 4. – P. 1293–1299.
- Existence of functionally distinct Thy 1+ and Thy-1– human female reproductive tract fibroblasts / L. Koumas, A. E. King, H. O. Critchley [et al.] // Am.J.Pathol. –2001.–Vol.159. – P. 925–935.
- Expression and characterization of a novel CD6 ligand in cells derived from joint and epithelial tissue /M.K.Saifullah, D.A.Fox, S.Sarkar [et al.]//J.Immunol.–2004.–Vol.15,№10.–P.6125–6133.
- Extendible replacements of the proximal tibia for bone tumors / R. J. Grimer, M. Belthur, S. R. Carter [et al.] // J. Bone Joint Surg. (Br). – 2000. – Vol. 82. – P. 255–259.
- Fibroblast invasive migration into fibronectin/fibrin gels requires a previously uncharacterized dermatan sulfate-CD44 proteoglycan / R. A. Clark, F. Lin, D. Greiling [et al.] // J. Invest. Dermatol. – 2004. – Vol. 122, № 2. – P. 266–277.
- Gangji V., Toungouz M., Hauzeur J.P. Stem cell therapy for osteonecrosis of the femoral head // Expert. Opin. Biol. Ther. – 2005. - Vol. 5, N 4. – P. 437-442.
- García-Martínez O., Reyes-Botella C., Aguilera-Castillo O. et al. Antigenic Profile of Osteoblasts Present in Human Bone Tissue Sections //Biosci. Reports. –2006.–Vol. 26, №1.– P. 39-43.
- Goel A., Sangwan S.S., Siwach R.C., Ali A.M. Percutaneous bone marrow grafting for the treatment of tibial non union // Injury. – 2005. – Vol. 36, N 1. – P. 203-206.
- Holland, J., Owens, T. Signaling through Intercellular Adhesion Molecule 1(ICAM-1) in a B Cell Lymphoma Line. The activation of Lyn tyrosine kinase and the mitogen-activated protein kinase pathway //J. Biol. Chem.–1997.– Vol. 272. – P. 9108-9112.
- Human IL-1β ELISA Kit II. Instruction Manual BD OptEIA. – San Diego: Becton, Dickinson and Co., USA, 2005. – 15 p.
- Human IL-2 ELISA Kit II. Instruction Manual BD OptEIA. – San Diego: Becton, Dickinson and Co., USA, 2005. – 16 p.
- Human IL-4 ELISA Kit II. Instruction Manual BD OptEIA. – San Diego: Becton, Dickinson and Co., USA, 2005. – 16 p.
- Human IL-6 ELISA Kit II. Instruction Manual BD OptEIA. – San Diego: Becton, Dickinson and Co., USA, 2005. – 16 p.
- Human IL-8 ELISA Kit II. Instruction Manual BD OptEIA. – San Diego: Becton, Dickinson and Co., USA, 2005. – 16 p.
- Human TNF ELISA Kit II. Instruction Manual BD OptEIA. – San Diego: Becton, Dickinson and Co., USA, 2005. – 16 p.
- Hyaluronan receptor expression increases in fetal excisional skin wounds and correlates with fibroplasia / H.N. Lovvorn, D.L. Cass, K.G. Sylvester [et al.]//J.Pediatr. Surg.–1998.–Vol.33,№ 7.–P.1062–1070.
- IL-3 acts directly on osteoclast precursors and irreversibly inhibits receptor activator of NFκB ligand-induced osteoclast differentiation by diverting the cells to macrophage lineage / S. M. Khapli, L. S. Mangashetti, S. D. Yogesha [et al.] // J. Immunol. – 2003. – Vol. 171. – P. 142–151.
- IL-6 and IL-8 production by human bone marrow stromal cells / F.Rougier, E.Cornu, V.Praloran [et al.] //Cytokine. – 1998. – Vol.10, № 2. – P. 93–97.
- IL-6 and its circadian secretion in humans / A.N.Vgontzas, E.O.Bixler, H.M.Lin [et al.] // Neuroimmunomodulation.–2005.–Vol. 12, № 3. – P. 131–140.
- IL-6, leukemia inhibitory factor, and oncostatin M stimulate bone resorption and regulate the expression of receptor activator of NFκB ligand, osteoprotegerin, and receptor activator of NFκB in mouse calvariae / P. Palmqvist, E. Persson, H. H. Conaway [et al.] // J. Immunol. – 2002. – Vol. 169. – P. 3353–3362.
- Integrin α2β1 promotes activation of protein phosphatase 2A and dephosphorylation of Akt and Glycogen synthase kinase 3β / J. Ivaska, L. Nissinen, N. Immonen [et al.] // Mol. Cell Biol. – 2002. – Vol. 22, № 5. – P. 1352–1359.
- Izuhara K. IL-4 and IL-13 : their pathological roles in allergic diseases and their potential in developing new therapies / K. Izuhara, K. Arima, S. Yasunaga // Current drug targets. Inflam. and allergy. – 2003. – Vol. 1, № 3. – P. 263–269.
- Jones S. A. Directing transition from innate to acquired immunity : defining a role for IL-6 / S. A. Jones // J. Immunol. – 2005. – Vol. 175, № 6. – P. 3463–3468.
- Kawate K., Yajima H., Ohgushi H. at al. Tissue engineered approach for the treatment of steroid induced osteonecrosis of the femoral head: transplantation of autologous mesenchymal stem cells cultured with beta tricalcium phosphate ceramics and free vascularized fibula //Artif. Organs.–2006.–Vol.30,N12.–P.960-962.
- Kuznetsov S. A., Robey P. G. A look at the history of bone marrow stromal cells // Graft. – 2000. – Vol. 3, N 6. – P. 278-283.
- Laminin-5 Induces Osteogenic Gene Expression in Human Mesenchymal Stem Cells through an ERK-dependent Pathway / R. F. Klees, R. M. Salasznyk, K. Kingsley [et al.] // Mol. Biol. Cell. – 2005. – Vol. 16, № 2. – P. 881–890.
- Le Maitre C. L. The role of interleukin-1 in the pathogenesis of human intervertebral disc degeneration / C.L.Le Maitre, A.J.Freemont, J.A.Hoyland //Arthritis Res. Ther.–2005.–Vol.7,№ 4.–P.732–745.
- Leucocyte typing VII. White cell differentiation antigens / D. Mason, P. André, A. Bensussan [et al.] // Proceedings of the 7-th International Workshop and Conference: 2000 Jun 19–23, Harrogate, United Kingdom. – New York : Oxford University Press Inc., 2002. – P. 793–794.
- Locksley R. M. The TNF and TNF receptor superfamilies: integrating mammalian biology / R. M. Locksley, N. Killeen, M. J. Lenardo // Cell. – 2001. – Vol. 104, № 4. – P. 487–501.
- Maeda S. Inflammatory cytokines (IL-4, IL-5 and IL-13)/ S.Maeda, Y.Yanagihara // Nippon Rinsho.–2001.– Vol.59,№10.– P. 1894–1899.
- Majumdar M. K. BMP-2 and BMP-9 promote chondrogenic differentiation of human multipotential mesenchymal cells and overcome the inhibitory effect of IL-1 / M. K. Majumdar, E. Wang, E. A. Morris // J. Cell. Physiol. – 2001. – Vol. 189, № 3. – P. 275–284.
- Mangashetti L. S. IL-4 inhibits bone-resorbing activity of mature osteoclasts by affecting NF-kappa B and Ca2+ signaling / L. S. Mangashetti, S. M. Khapli, M. R. Wani // J. Immunol. – 2005. – Vol. 175. – P. 917–925.
- Marie P.J. Facteurs systémiques et locaux du remodelage osseux/ P.J. Marie, M.C. de Vernejoul, D.Kuntz //Maladies métaboliques osseuses de l’adulte.–Paris: Flammarion,1996.–P. 49–70.
- Marie P. J. Osteoblasts and bone formation / P. J. Marie // Advances in organ biology: molecular and cellular biology of bone. – Stamford, CT (USA): JAI Press,1999.–№5B.– P. 401–427.
- Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement / M. Dominici, K. Le Blanc, I. Mueller [et al.] // Cytotherapy. – 2006. – Vol. 8, № 4. – P. 315–317.
- Nicholson I. C. CD62L (L-selectin) / I. C. Nicholson // J. Biol. Regul. Homeost. Agents.–2003.–Vol. 16, № 2. – P. 144–146.
- Niemeyer P.,Krause U.,Kasten P. at oll. Mesenchymal Stem Cell-Based HLA-Independent Cell Therapy for Tissue Engineering of Bone and Cartilage // Current Stem Cell Research and Therapy. – 2006. – Vol. 1, N 1. – P. 21-27.
- Noshi T., Yoshikawa T., Ikeuchi M., at all. Enhancement of the in vivo osteogenic potential of marrow/hydroxyapatite composites by bovine bone morphogenetic protein // J. Biomed. Mater. Res. – 2000. – Vol. 52, N 4. – P. 621-630.
- Oyajobi B.O., Lomri A., Hott M. Isolation and characterization of human clonogenic osteoblast progenitors immunoselected from fetal bone marrow stroma using STRO-1 monoclonal antibody// J. Bone Miner. Res. – 1999. – V. 14, N 3. – P. 351-361.
- Poudrier J. Owens T. CD54/intercellular adhesion molecule 1 and major histocompatibility complex II signaling induces B cells to express interleukin 2 receptors and complements help provided through CD40 ligation //J. Experimental Medicine.–1994. – Vol. 179. – P. 1417-1427.
- Quarto R., Mastrogiacomo M., Cancedda R., Kutepov S.M., Mukhachev V., Lavroukov A., Kon E., Marcacci M. Repair of large bone defects with the use of autologous bone marrow stromal cells // N. Engl. J. Med. – 2001. – Vol. 344, N 5. – P. 385-386.
- Roodman G. D. Role of cytokines in the regulation of bone resorption /G. D. Roodman //Calcif. Tissue Int.–1993.–Vol. 53, № 1. – P. 94–98.
- Ruiz С., Pérez Е., García-Martínez О. et al. Expression of cytokines IL-4, IL-12, IL-15, IL-18, and IFNγ and modulation by different growth factors in cultured human osteoblast-like cells // J. Bone Miner.; Metab. – 2007. – Vol. 25, №5. - Р. 286-292.
- Schwartz M. A. Networks and crosstalk: integrin signalling spreads / M. A. Schwartz, M. H. Ginsberg // Nat. Cell Biol.– 2002. – Vol. 4. – P. 65–68.
- Soluble and cell-associated forms of the adhesion molecule LFA-3 (CD58) are differentially regulated by inflammatory cytokines / A. C. Kirby, P. Cahen, S. R. Porter [et al.] // Cell Adhes. Commun. – 2000. – Vol. 7, № 6. – P. 453–464.
- Swart G. W. Activated leukocyte cell adhesion molecule (CD166/ALCAM): developmental and mechanistic aspects of cell clustering and cell migration / G. W. Swart // Eur. J. Cell Biol. – 2002. – Vol. 81, № 6. – P. 313–321.
- The role of interleukin-8 in cancer cells and microenvironment interaction / A. Yuan, J. J. Chen, P. L. Yao [et al.] // Front. Biosci. – 2006. – Vol. 10. – P. 853–865.
- The role of interleukin-8 in cancer cells and microenvironment interaction / A. Yuan, J. J. Chen, P. L. Yao [et al.] // Front. Biosci. – 2006. – Vol. 10. – P. 853–865.
- Turksen K., Aubin J.E. Positive and negative immunoselection for enrichment of two classes of osteoprogenitor cells // J. Cell Biol. – 1991. – V. 114, N2. – P. 373-384.
- Waldmann T. A. The biology of interleukin-2 and interleukin-15: implications for cancer therapy and vaccine design / T. A. Waldmann //Nature Rev. Immun.–2006.–Vol.6,№8.– P. 595–601.
- Welty-wolf K.E, Carraway M. S., Huang Y.T., Simonson S.G., Kantrow S.P. Kishimoto T.K. Plantadosi C.A.Antibody to Intercellular Adhesion Molecule 1 (CD54) Decreases Survival and Not Lung Injury in Baboons with Sepsis // Am. J. Respir. Crit. Care Med. – 2001. – Vol. 163, N 3. – P. 665-673.