Журнал «Травма» Том 10, №4, 2009
Вернуться к номеру
Витамин D, D-гормон и Альфакальцидол: медицинские, молекулярно-биологические и фармакологические аспекты
Авторы: Г.Я.Шварц - Институт прикладной фармакологии, Москва, Российская Федерация
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
В статье приведен анализ различных форм дефицита витамина D, оптимальных путей коррекции данных форм дефицита. Подробно объяснен путь метаболизма витамина D в организме. Также показана взаимосвязь между дефицитом активных метаболитов витамина D и различными формами остеопороза. На примере ряда исследований показано преимущество терапии остеопороза активными формами витамина Д (альфа-кальцидол). Приведены данные клинических рекомендаций Российской ассоциации по остеопорозу 2008 г. относительно использования активных форм витамина Д.
У статті наведений аналіз різних форм дефіциту вітаміну D, оптимальних шляхів корекції даних форм дефіциту. Докладно пояснений шлях метаболізму вітаміну D в організмі. Також показаний взаємозв''язок між дефіцитом активних метаболітів вітаміну D і різними формами остеопорозу. На прикладі ряду досліджень показана перевага терапії остеопорозу активними формами вітаміну Д (альфакальцидол). Наведено дані клінічних рекомендацій Російської асоціації по остеопорозу 2008 р., щодо використання активних форм вітаміну Д.
This article deals with different forms of vitamin D deficiency and its optimal ways of correction. It specifies the pathway of vitamin D in the body. Besides, it explains the correlation between active metabolites of vitamin D and various forms of osteoporosis. A lot of investigations prove to the advantage of osteoporosis treatment by active forms of vitamin D (alfacal-cidol). It outlined clinical recommendations of Russian Association of Osteoporrosis 2008, concerning usage of active forms of vitamin D.
остеопороз, альфакальцидол, дефицит витамина Д
остеопороз, альфакальцидол, дефіцит вітаміну Д
osteoporosis, alfacalcidol, vitamin D deficiency
Нарушение образования гормонов и их дефицит являются важными причинами многих заболеваний человека. Дефицит одного из них – D-гормона (чаще обозначаемый как дефицит витамина D), обладающего широким спектром биологических свойств и участвующего в регуляции многих важных физиологических функций, – также имеет негативные последствия и лежит в основе ряда видов патологических состояний и заболеваний [1,3,4,6,8-14]. Ниже рассматриваются как характеристики витамина D, его дефицита, роль последнего в возникновении и развитии ряда распространенных заболеваний, так и современные возможности фармакологической коррекции D-дефицитных состояний.
Характеристика витамина D, D-гормона и D-эндокринной системы. Термин «витамин D» в определенной степени условен. Он объединяет группу сходных по химическому строению (секо-стероиды) и существующих в природе нескольких веществ:
- витамин D1 (так было названо открытое в 1913 г. E.V. McCollum’ом в жире из печени трески вещество, представляющее собой соединение эргокальциферола и люмистерола в соотношении 1:1);
- витамин D2 – эргокальциферол, образующийся из эргостерола под действием солнечного света главным образом в растениях; представляет собой одну из двух, наряду с витамином D3, наиболее распространенных природных форм витамина D;
- витамин D3 – холекальциферол, образующийся в организме животных и человека под действием солнечного света из 7-дегидрохолестерина; именно его рассматривают как «истинный» витамин D, тогда как другие представители этой группы считают модифицированным производными витамина D;
- витамин D4 – дигидротахистерол или 22,23-дигидроэргокальциферол;
- витамин D5 – ситокальциферол (образуется из 7-дегидроситостерола).
Витамин D традиционно относят к группе жирорастворимых витаминов. Однако в отличие от всех других витаминов витамин D не является собственно витамином в классическом смысле этого термина, так как:
а) биологически не активен,
б) за счет двухступенчатой метаболизации в организме превращается в активную – гормональную форму;
в) оказывает многообразные биологические эффекты за счет взаимодействия со специфическими рецепторами, локализованными в ядрах клеток многих тканей и органов. В этом отношении активный метаболит витамина D ведет себя как истинный гормон, в связи с чем и получил название D-гормон. При этом, следуя исторической традиции, в научной литературе его называют витамином D.
В организм человека витамин D2 поступает в относительно небольших количествах – не более 20–30% от потребности. Основными его поставщиками являются продукты из злаковых растений, рыбий жир, сливочное масло, маргарин, молоко, яичный желток и др. Витамин D2 метаболизируется с образованием производных, обладающих сходным с метаболитами витамина D3 действием.
Вторая природная форма витамина D – витамин D3, или холекальциферол, является малозависящим от поступления извне ближайшим аналогом витамина D2. Холекальциферол образуется в организме позвоночных животных, в том числе амфибий, рептилий, птиц и млекопитающих, в связи с чем играет значительно большую роль в процессах жизнедеятельности человека, чем поступающий в небольших количествах с пищей витамин D2. В организме витамин D3 образуется из находящегося в дермальном слое кожи предшественника – провитамина D3 (7-дегидрохолестерина) – под влиянием коротковолнового ультрафиолетового облучения спектра В (УФ-В/солнечного света, длина волны 290–315 нм) при температуре тела в результате фотохимической реакции раскрытия В кольца стероидного ядра и термоизомеризации, характерной для секостероидов.
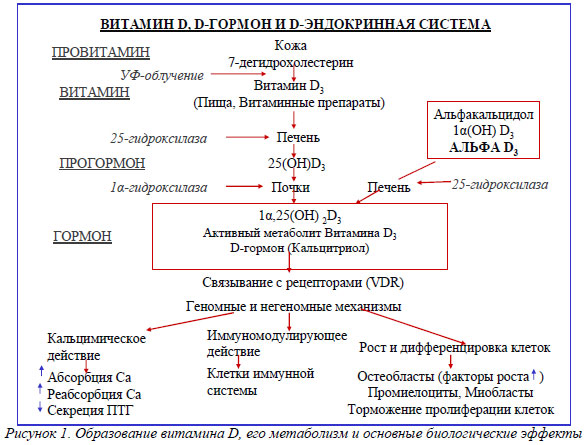
Витамин D (поступающий с пищей или образующийся в организме в процессе эндогенного синтеза) в результате двух последовательных реакций гидроксилирования биологически малоактивных прегормональных форм подвергается превращению в активные гормональные формы: наиболее важную, качественно и количественно значимую - 1a,25-дигидроксивитамин D3 (1a,25(ОН)2D3; называемый также D-гормоном, кальцитриолом) и минорную - 24,25(ОН)2D3 (схема на рис.1 ).
Уровень образования D-гормона в организме взрослого здорового человека составляет около 0,3–1,0 мкг/сут. Первая реакция гидроксилирования осуществляется преимущественно в печени (до 90%) и около 10% 1,25-дигидроксивитамина D3 строго регулируется рядом эндогенных и экзогенных факторов.
Гидроксилирование витамина D3 в печени не является объектом каких-либо внепеченочных регулирующих влияний и представляет собой полностью субстратзависимый процесс. Реакция 25-гидроксилирования протекает весьма быстро и ведет к повышению уровня 25(ОН)D в сыворотке крови. Уровень этого вещества отражает как образование витамина D в коже, так и его поступление с пищей, в связи с чем может использоваться как маркер статуса витамина D. Частично транспортная форма 25(ОН)D поступает в жировую и мышечную ткани, где может создавать тканевые депо с неопределенным сроком существования. Последующая реакция 1a-гидроксилирования 25(ОН)D протекает в основном в клетках проксимальных отделов канальцев коры почек при участии фермента 1a-гидроксилазы (25-гидроксивитамин D-1-альфа-гидроксилаза, CYP27В1). В меньшем, чем в почках, объеме 1a-гидроксилирование осуществляется и клетками лимфогемопоэтической системы, в костной ткани и, как установлено в последнее время, клетками некоторых других тканей, содержащими как 25(ОН)D, так и 1a-гидроксилазу. Как 25-гидроксилаза (СYP27В1 и ее другие изоформы), так и 1a-гидроксилаза представляют собой классические митохондриальные и микросомальные оксидазы со смешанными функциями и участвуют в переносе электронов от НАДФ через флавопротеины и ферродоксин в цитохром Р-450 ( Gupta et al., 2004). В результате второй реакции гидроксилирования образуется активный метаболит витамина D – 1α,25-дигидроксивитамин D3 (1α,25(ОН)2D3 или кальцитриол или D-гормон), а также менее активный 24R,25(ОН)2D3. Образование в почках 1,25-дигидроксивитамина D3 строго регулируется рядом эндогенных и экзогенных факторов.
В частности, регуляция синтеза 1a,25(ОН)2D3 в почках является непосредственной функцией паратиреоидного гормона (ПТГ), на концентрацию которого в крови в свою очередь по механизму обратной связи оказывают влияние как уровень самого активного метаболита витамина D3, так и концентрация кальция и фосфора в плазме крови. Кроме того, активирующее влияние на 1a-гидроксилазу и процесс 1a-гидроксилирования оказывают и другие факторы, к числу которых относятся половые гормоны (эстрогены и андрогены), кальцитонин, пролактин, гормон роста (через ИПФР-1) и др.; ингибиторами 1a-гидроксилазы являются 1a,25(ОН)2D3 и ряд его синтетических аналогов, глюкокортикостероидные (ГКС) гормоны и др. Фактор роста из фибробластов (FGF23), секретируемый в клетках кости, вызывает образование натрий-фосфат-котранспортера, который действует в клетках почек и тонкого кишечника, оказывает тормозящее влияние на синтез 1,25-дигидроксивитамина D3. На метаболизм витамина D оказывают влияние и некоторые лекарственные средства (ЛС, например, противоэпилептические средства).
1α,25-дигидроксивитамин D3 повышает экспрессию 25-гидроксивитамин D-24-гидроксилазы (24-ОНазы) – фермента, катализирующего его дальнейший метаболизм, что приводит к образованию водорастворимой биологически неактивной кальцитроевой кислоты, которая выделяется с желчью.
Последние исследования демонстрируют, что у пациентов с дефицитом D-гормона достаточно часто имеется нормальный уровень 25(ОН)D, иными словами, у данных пациентов не определяется дефицит витамина D на фоне выраженного дефицита D-гормона и соответствующих эффектов этого дефицита (нарушение всасывания Са, мышечная слабость и т.д.). По мнению исследователей, это связанно с дефицитом 1α-гидроксилазы в почках, что, по современным представлениям о патогенезе остеопороза, является ключевым звеном всех без исключения форм данного заболевания (вторичного, инволютивного, постменопаузального и т.д.) [3,7,8,14,15].
Все перечисленные компоненты метаболизма витамина D, а также тканевые ядерные рецепторы к 1α,25-дигидроксивитамин D3 (D-гормону), получившие название рецепторы к витамину D (РВD), объединяют в эндокринную систему витамина D, функции которой состоят в способности генерировать биологические реакции в более чем 40 тканях-мишенях за счет регуляции РВD’ми транскрипции генов (геномный механизм) и быстрых внегеномных реакций, осуществляемых при взаимодействии с РВD, локализованными на поверхности ряда клеток. За счет геномных и внегеномных механизмов D-эндокринная система осуществляет реакции поддержания минерального гомеостаза (прежде всего, в рамках кальций-фосфорного обмена), концентрации электролитов и обмена энергии. Кроме того, она принимает участие в поддержании адекватной минеральной плотности костей, метаболизме липидов, регуляции уровня АД, роста волос, стимуляции дифференцировки клеток, ингибировании клеточной пролиферации, реализации иммунологических реакций (иммунодепрессивное действие).
При этом лишь сам D-гормон и гидроксилирующие ферменты являются активными компонентами D-эндокринной системы.
Важнейшими реакциями, в которых 1α,25(ОН)2D3 участвует как кальцемический гормон, являются абсорбция кальция в ЖКТ и его реабсорбция в почках. D-гормон усиливает кишечную абсорбцию кальция в тонком кишечнике за счет взаимодействия со специфическими РВD – представляющими собой Х-рецепторный комплекс ретиноивой кислоты (РВD-ХРК), ведущего к экспрессии в кишечном эпителии кальциевых каналов [1, 6, 8]. Эти временные (т.е. существующие непостоянно), потенциал-зависимые катионные каналы, относятся к 6-му члену подсемейству V (TRPV6). В кишечных энтероцитах активация РВД сопровождается анаболическим эффектом – повышением синтеза кальбидина 9К - кальций-связывающего белка (СаСБ), который выходит в просвет кишечника, связывает Са++ и транспортирует их через кишечную стенку в лимфатические сосуды и затем в сосудистую систему. Об эффективности данного механизма свидетельствует тот факт, что без участия D-гормона лишь 10-15% пищевого кальция и 60% фосфора абсорбируются в кишечнике. Взаимодействие между 1α,25-дигидроксивитамином D3 и РВD повышает эффективность кишечной абсорбции Са++ до 30-40%, т.е. в 2-4 раза, а фосфора – до 80%. Сходные механизмы действия D-гормона лежат в основе осуществляемой под его влиянием реабсорбции Са++ в почках.
В костях 1α,25(ОН)2D3 связывается с рецепторами на кость-формирующих клетках – остеобластах (ОБ), вызывая повышение экспрессии лиганда рецептора активатора ядерного фактора кВ (RANKL) [6,8]. Рецептор активатор ядерного фактора кВ (RANK), являющийся рецептором для RANKL, локализованным на преостеокластах (преОК), связывает RANKL, что вызывает быстрое созревание преОК и их превращение в зрелые ОК. В процессах костного ремоделирования зрелые ОК резорбируют кость, что сопровождается выделением кальция и фосфора из минерального компонента (гидроксиапатита) и обеспечивает поддерждание уровеня кальция и фосфора в крови. В свою очередь адекватный уровень кальция (Са++) и фосфора (в виде фосфата (НРО4 2-) необходим для нормальной минерализации скелета.
D-дефицит. В физиологических условиях потребность в витамине D варьирует от 200 МЕ (у взрослых) до 400 МЕ (у детей) в сутки. Считается, что кратковременное (в течение 10–30 мин.) солнечное облучение лица и открытых рук эквивалентно приему примерно 200 МЕ витамина D, тогда как повторное пребывание на солнце в обнаженном виде с появлением умеренной кожной эритемы вызывает повышение уровня 25(ОН)D, выше наблюдаемого при многократном его введении в дозе 10 000 МЕ (250 мкг) в день [8,11, 12]. Хотя консенсус относительно оптимального уровня 25(ОН)D, измеряемого в сыворотке крови и отсутствует, дефицит витамина D (ДВD), по мнению большинства экспертов, имеет место тогда, когда 25(ОН)D ниже 20 нг/мл (т.е. ниже 50 нмол/л). Уровень 25(ОН)D обратно пропорционален уровню ПТГ в пределах, когда уровень последнего (ПТГ) достигает интервала между 30 и 40 нг/мл (т.е. от 75 до 100 нмол/л), при указанных значениях которого концентрация ПТГ начинает снижаться (от максимальной). Более того, кишечный транспорт Са++ повышался до 45-65% у женщин, когда уровень 25(ОН)D увеличивался в среднем от 20 до 32 нг/мл (от 50 до 80 нмол/л). На основании этих данных, уровень 25(ОН)D от 21 до 29 нг/мл (т.е. 52 до 72 нмол/л) может рассматриваться как индикатор относительной недостаточности витамина D, а уровень 30 нг/мл и выше - как достаточный (т.е. близкий к нормальному). Интоксикация витамином D наблюдается, когда уровень 25(ОН)D выше, чем 150 нг/мл (374 нмол/л).
Дефицит D-гормона (чаще представленный D-гиповитаминозом либо D-витаминной недостаточностью, т.к. в отличие от драматического снижения уровня эстрогенов в постменопаузе этим термином обозначают преимущественно снижение уровня образования в организме 25(ОН)D и 1a,25(ОН)2D3), а также нарушения его рецепции играют существенную роль в патогенезе не только заболеваний скелета (рахит, остеомаляция, остеопороз), но и значительного числа распространенных внескелетных заболеваний (сердечно-сосудистая патология, опухоли, аутоиммунные заболевания и др.)
Различают два основных типа дефицита D-гормона [8, 12], иногда называемого также «синдромом D-недостаточности». Первый из них обусловлен дефицитом/недостаточностью витамина D3 – природной прогормональной формы, из которой образуется активный(е) метаболит(ы) [1a,25(ОН)2D3]. Из-за изменившейся во второй половине ХХ века демографической ситуации этот тип дефицита витамина D нередко имеет место у лиц пожилого возраста. Показано, что у людей в возрасте 65 лет и старше наблюдается 4-кратное снижение способности образовывать витамин D в коже. В связи с тем что 25(ОН)D является субстратом для фермента 1a-гидроксилазы, а скорость его превращения в активный метаболит пропорциональна уровню субстрата в сыворотке крови, снижение этого показателя <30 нг/мл нарушает образование адекватных количеств 1a,25(ОН)2D3. Именно такой уровень снижения 25(ОН)D в сыворотке крови был выявлен у 36% мужчин и 47% женщин пожилого возраста в ходе исследования (Euronut Seneca Program), проведенного в 11 странах Западной Европы. И хотя нижний предел концентрации 25(ОН)D в сыворотке крови, необходимый для поддержания нормального уровня образования 1a,25(ОН)2D3, неизвестен, его пороговые значения, по-видимому, составляют от 12 до 15 нг/мл (30–35 нмол/л).
Наряду с приведенными выше данными, в последние годы появились и более четкие количественные критерии D-дефицита. Согласно авторам, гиповитаминоз D определяется при уровне 25(ОН)D в сыворотке крови 100 нмол/л (40 нг/мл), D-витаминная недостаточность – при 50 нмол/л, а D-дефицит – при <25 нмол/л (10 нг/мл). Последствием этого типа дефицита витамина D являются снижение абсорбции и уровня Са++, а также повышение уровня ПТГ в сыворотке крови (вторичный гиперпаратиреоидизм), нарушение процессов ремоделирования и минерализации костной ткани. Дефицит 25(ОН)D рассматривают в тесной связи с нарушениями функций почек и возрастом, в том числе с количеством лет, прожитых после наступления менопаузы.
Дефицит 25(ОН)D выявлен также и при синдроме мальабсорбции, болезни Крона, состояниях после субтотальной гастрэктомии или обходных операциях на кишечнике, недостаточной секреции панкреатического сока, циррозе печени, врожденной атрезии желчного протока, длительном применении противосудорожных (антиэпилептических) ЛС, нефрозах.
Другой тип дефицита витамина D не всегда определяется снижением продукции D-гормона в почках (при этом типе дефицита может наблюдаться либо нормальный, либо слегка повышенный его уровень в сыворотке крови), но характеризуется снижением его рецепции в тканях (резистентность к гормону), что рассматривается как функция возраста. Тем не менее снижение уровня 1a,25(ОН)2D3 в плазме крови при старении, особенно в возрастной группе старше 65 лет, отмечается многими авторами. Снижение почечной продукции 1a,25(ОН)2D3 наблюдается при остеопорозе и обусловлено снижением активности почечной гидроксилазы (1α гидроксилазы), согласно современным представлениям - ключевого пункта патогенеза всех типов и форм остеопороза. Также это наблюдается при заболеваниях почек (ХПН и др.), у лиц пожилого возраста (>65 лет), при дефиците половых гормонов, гипофосфатемической остеомаляции опухолевого генеза, при ПТГ-дефицитном и ПТГ-резистентном гипопаратиреозе, сахарном диабете, под влиянием применения препаратов ГКС и др. Развитие резистентности к 1a,25(ОН)2D3 обусловлено, как полагают, снижением числа РВD в тканях-мишенях и прежде всего в кишечнике, почках и скелетных мышцах. Оба варианта дефицита витамина D являются существенными звеньями патогенеза ОП, падений и переломов.
Проведенные в последние годы масштабные исследования позволили выявить статистически значимую корреляцию между ДВD и распространенностью ряда заболеваний. При этом важная информация, в частности, была получена при исследовании связей между ДВD и сердечно-сосудистыми и онкологическими заболеваниями.
Так, описано 16 различных видов злокачественных опухолей, развитие которых коррелирует с низкой инсоляцией/УФ-облучением, а их распространенность повышается при D-дефиците/недостаточности [11]. Среди них: рак молочной железы, толстой и прямой кишки, матки, пищевода, яичников, ходжкинская и неходжкинская лимфома, рак мочевого пузыря, желчного пузыря, желудка, поджелудочной и предстательной желез, почек, яичек и влагалища. Данные, касающиеся связи между D-дефицитом/недостаточностью и отдельными видами онкологической патологии, получены в ряде когортных исследований или с использованием методологии случай–контроль.
Эти исследования подтвердили наличие корреляции между распространенностью и смертностью от злокачественных опухолей молочной железы, толстой кишки, яичников и предстательной железы и интенсивностью солнечной радиации в месте постоянного проживания пациентов, продолжительностью их пребывания на солнце и уровнем витамина D в сыворотке крови [11].
Все эти данные как специалисты, так и органы здравоохранения США и стран Западной Европы рассматривают как «эпидемию ДВD», имеющую серьезные медицинские и медико-социальные последствия.
Фармакологическая коррекция D-дефицита. Как показано выше, ДВD является одним из существенных факторов риска ряда хронических заболеваний человека. Восполнение этого дефицита за счет адекватного пребывания на солнце либо при искусственном УФ-облучении является важным элементом профилактики этих заболеваний. Использование препаратов витамина D, особенно его активных метаболитов – перспективное направление в лечении распространенных видов патологии, и наряду с традиционными методами терапии они открывают новые возможности для практической медицины [6, 8, 12].
По фармакологической активности препараты витамина D разделяют на две группы. В первую из них объединены обладающие умеренной активностью нативные витамины D2 (эргокальциферол) и D3 (холекальциферол), а также структурный аналог витамина D3 – дигидротахистерол. Витамин D2 наиболее часто используется в составе поливитаминных препаратов для детей и взрослых. По активности 1 мг витамина D2 эквивалентен 40 000 МЕ витамина D. Обычно витамин D2 выпускают в капсулах или таблетках по 50 000 МЕ (1,25 мг) или в масляном растворе для инъекций по 500 000 МЕ/мл (12,5 мг) в ампулах. Безрецептурные препараты для приема внутрь (растворы) содержат 8000 МЕ/мл (0,2 мг) витамина D2. В соответствии с содержанием действующих веществ препараты этой группы относят к микронутриентам (пищевым добавкам)
Во вторую группу входят активный метаболит витамина D3 и его аналоги: кальцитриол, альфакальцидол («Альфа Д3-Тева») – проD-гормон и др. [1, 2, 6, 7, 8].
Механизм действия препаратов обеих групп аналогичен таковому природного витамина D и заключается в связывании с РВD в органах-мишенях и обусловленными их активацией фармакологическими эффектами (усиление всасывания кальция в кишечнике и др.). Различия в действии отдельных препаратов носят в основном количественный характер и определяются особенностями их фармакокинетики и метаболизма. Так, препараты нативных витаминов D2 и D3 («Кальций Д3-Никомед», «Кальцемин» и другие) подвергаются в печени 25-гидроксилированию с последующим обязательным превращением в почках в активный метаболит 1,25(ОН)2D3, оказывающий соответствующие фармакологические эффекты. В связи с тем что активность гидроксилазы в почках снижена при всех формах остеопороза, соответственно и снижается интенсивность метаболизма препаратов нативного витамина D при разных типах и формах первичного и вторичного ОП у пациентов, страдающих заболеваниями ЖКТ, печени, поджелудочной железы и почек (ХПН), а также на фоне приема, например, противосудорожных и других ЛС, усиливающих метаболизм 25(ОН)D до неактивных производных. Кроме того, дозы витаминов D2 и D3 и их аналогов в лекарственных формах (как правило, близкие к физиологическим потребностям в витамине D – 200–800 МЕ/сут.) способны в физиологических условиях усиливать абсорбцию кальция в кишечнике, но не позволяют преодолеть его мальабсорбцию при разных формах ОП, вызывающих подавление секреции ПТГ, и не оказывают отчетливого положительного влияния на костную ткань [1,2,4, 6,8].
Этих недостатков лишены препараты, содержащие активные метаболиты витамина D3 (в последние годы их применяют с лечебными целями значительно шире, чем препараты нативного витамина): 1a,25(ОН)2D3 (МНН – кальцитриол; химически идентичен собственно D-гормону) и его синтетическое 1a-производное – 1a(ОН)D3 (МНН – альфакальцидол, зарегистрирован под торговой маркой Альфа Д3-Тева – проD-гормон). Оба препарата сходны по спектру фармакологических свойств и механизму действия, но различаются по фармакокинетическим параметрам, переносимости и некоторым другим характеристикам [1,2,3,6,8].
В фармакокинетике препаратов на основе нативных форм витамина D, их активных метаболитов и производных имеются существенные различия, во многом определяющие их практическое использование. Нативные витамины D2 и D3 всасываются в верхнем отделе тонкого кишечника, поступая в составе хиломикронов в его лимфатическую систему, печень и далее в кровеносное русло. Их максимальная концентрация в сыворотке крови наблюдается в среднем через 12 ч. после приема однократной дозы и возвращается к исходному уровню через 72 ч. На фоне длительного применения этих препаратов, особенно в больших дозах, их выведение из циркуляции значительно замедляется и может достигать месяцев, что связывают с возможностью депонирования витаминов D2 и D3 в жировой и мышечной тканях [8]. Витамин D экскретируется с желчью в виде более полярных метаболитов. Подробно изучена фармакокинетика активного метаболита витамина D – кальцитриола [1a,25(ОН)2D3]. После приема внутрь он быстро всасывается в тонком кишечнике. Максимальная концентрация кальцитриола в сыворотке крови достигается через 2–6 ч. и существенно снижается через 4–8 ч. Период полувыведения составляет 3–6 ч. При повторном приеме равновесные концентрации достигаются в пределах 7 сут. В отличие от природного витамина D3, кальцитриол, не требующий дальнейшей метаболизации для превращения в активную форму, после приема внутрь в дозах 0,25–0,5 мкг, благодаря взаимодействию с внеядерными рецепторами энтероцитов слизистой оболочки кишечника, вызывает уже через 2–6 ч. повышение кишечной абсорбции кальция. Предполагают, что экзогенный кальцитриол проникает из крови матери в кровоток плода, выделяется с грудным молоком. Выводится с желчью и подвергается энтерогепатической циркуляции. Идентифицировано несколько метаболитов кальцитриола, которые обладают в разной степени выраженными свойствами витамина D; к их числу относятся 1a,25-дигидрокси-24-оксохолекальциферол, 1a,23,25-тригидрокси-24-оксохолекальциферол и др.
При значительном сходстве в свойствах и механизмах действия между препаратами активных метаболитов витамина D существуют и заметные различия. Особенностью альфакальцидола (Альфа Д3-Тева) как пролекарства является то, что он, как было уже отмечено выше, превращается в активную форму, метаболизируясь в печени до 1a,25(ОН)2D3, и, в отличие от препаратов нативного витамина D, не нуждается в почечном гидроксилировании, что позволяет использовать его у пациентов с заболеваниями почек, а также у лиц пожилого возраста со сниженной почечной функцией. Вместе с тем установлено, что действие кальцитриола развивается быстрее и сопровождается более выраженным гиперкальциемическим эффектом, чем у альфакальцидола (наиболее широко применяемым в России препаратом альфакальцидола является «Альфа Д3-Тева»), тогда как последний оказывает лучший эффект на костную ткань (Дамбахер, Шахт, 1996; Рожинская, Родионова, 1997). Поэтому более безопасным является использование в клинической практике альфакальцидола. Кальцитриол, в связи с узким терапевтическим «окном» и более высоким риском развития побочных эффектов, рекомендуется использовать только в особых случаях (тяжелое поражение печени и т.д.). Особенности фармакокинетики и фармакодинамики этих препаратов определяют режим их дозирования и кратность назначения. Так, поскольку период полувыведения кальцитриола относительно короток, то для поддержания стабильной терапевтической концентрации его следует назначать не менее 2–3 раз в сутки. Действие альфакальцидола («Альфа Д3-Тева») развивается медленнее, однако после однократного введения оно более продолжительно, что определяет его назначение в дозах 0,25–1 мкг 1–2 раза в сутки [1,2,8].
Препараты нативных витаминов D2 и D3, а также их активных метаболитов относятся к числу наиболее хорошо переносимых и безопасных ЛС, применяемых для профилактики и лечения ОП. Данное положение имеет большое практическое значение в связи с тем, что их применение обычно достаточно продолжительно – в течение многих месяцев и даже лет. Клинические наблюдения свидетельствуют о том, что при индивидуальном подборе доз препаратов витамина D на основе оценки уровня кальция в плазме крови риск развития побочных эффектов минимален [1-6,8]. Связано это с присущей этим препаратам большой широтой терапевтического действия. Тем не менее при применении активных метаболитов витамина D примерно у 1–2% пациентов возможно развитие ряда побочных эффектов, наиболее частыми из которых являются гиперкальциемия и гиперфосфатемия, что связано с одним из основных механизмов их действия – усилением кишечной абсорбции кальция и фосфора. Оба эти эффекта могут проявляться недомоганием, слабостью, сонливостью, головными болями, тошнотой, сухостью во рту, запором или поносом, дискомфортом в эпигастральной области, болями в мышцах и суставах, кожным зудом, сердцебиениями. При индивидуально подобранной дозе указанные побочные эффекты наблюдаются достаточно редко.
Международный и отечественный опыт применения препаратов активного метаболита витамина D – кальцитриола и альфакальцидола для профилактики и лечения разных типов и форм ОП, а также профилактики падений и переломов суммирован в клинических рекомендациях «Остеопороз.Диагностика, профилактика и лечение» 2008 г., подготовленных Российской ассоциацией по остеопорозу [5]. Заключение и рекомендации, касающиеся использования лекарственных препаратов на основе активных метаболитов витамина D при лечении остеопороза, содержащиеся в указанном документе, представлены в таблицах 1 и 2.
Таким образом, препараты витамина D представляют собой группу эффективных и безопасных ЛС, применяемых главным образом при заболеваниях, в патогенезе которых ведущую роль играет D-дефицит/недостаточность и связанные с ним нарушения минерального обмена. Препараты нативного витамина D, особенно в физиологических дозах, за счет коррекции эндогенного D-дефицита/недостаточности оказывают профилактическое действие при рахите, а также в отношении остеопоретического процесса, могут снижать его интенсивность и предупреждать развитие переломов. Применение препаратов нативного витамина D целесообразно главным образом при 1-м типе D-дефицита, обусловленном недостатком инсоляции и поступления витамина D с пищей. Препараты активных метаболитов витамина D (альфакальцидол и, реже, кальцитриол) показаны как при 1-м, так и 2-м типе D-дефицита. За счет значительно более высокой, чем у препаратов нативного витамина D, фармакологической активности они способны преодолевать резистентность тканевых РВD к агонисту, не нуждаются для превращения в активную форму в метаболизации в почках. Препараты проD-гормона и D-гормона на сегодняшний день являются наиболее перспективными в профилактике и лечении разных типов и форм остеопороза, достоверно в два раза эффективнее, чем обычные формы витамина D, снижают риск переломов, а также предотвращают падения при разных типах и формах ОП. Они могут применяться как в монотерапии, так и в комбинации с другими антиостеопоротическими средствами (например, с бисфосфонатами, средствами ЗГТ) и солями кальция. Индивидуальный подбор дозировок кальцитриола и альфакальцидола позволяет свести к минимуму риск развития побочных эффектов, что вместе с предупреждением возникновения новых переломов, устранением болевого синдрома и улучшением двигательной активности способствует повышению качества жизни пациентов, прежде всего пожилого и старческого возраста.
Высокий уровень D-дефицита в популяции и установление его ассоциации с рядом распространенных внескелетных заболеваний (сердечно-сосудистых, онкологических, неврологических и др.) обусловливает целесообразность дальнейших исследований по установлению возможностей их лечения с помощью лекарственных средств из группы активного метаболита витамина Д.
1.Дамбахер М.А., Шахт Е. Остеопороз и активные метаболиты витамина D: мысли, которые приходят в голову. Eular Publishers, Basel, 1996 – 139p.
2. Марова Е.И., Родионова С.С., Рожинская Л.Я., Шварц Г.Я. Альфакальцидол (Альфа-Д3) в профилактике и лечении остеопороза. Метод. рекомендации. М., 1998. - 35с.
3.Рожинская Л.Я.Системный остеопороз. Практическое руководство., М., Издатель Мокеев, 2-е изд., 2000.-196с.
4. Насонов Е.Л., Скрипникова И.А., Насонова В.А. Проблема остеопороза в ревматологии, М., Стин, 1997. – 429с.
5. Остеопороз. Под ред. О.М.Лесняк, Л.И.Беневоленской – 2-е изд., перераб. и доп. – М.:ГЭОТАР-Медиа, 2009.-272с.
6. Шварц Г.Я. Витамин D, D-гормон и альфакальцидол:молекулярно-биологические и фармакологические аспекты //Остеопороз и остеопатии, 1998. - №3. - С.2-7.
7. Шварц Г.Я. Фармакотерапия остеопороза. М.: Медицинское информационное агенство, 2002. - 368с.
8. Шварц Г.Я. Витамин D и D-гормон. М.:Анахарсис, 2005. – 152с.
9. Шварц Г.Я. Остеопороз, падения и переломы в пожилом возрасте: роль D-эндокринной системы // РМЖ.- 2008. – Т.17, №10. – С.660-669.
10. Autier P., Gaudini S. Vitamin D supplementation and total mortality //Arch Intern Med, 2007, 167 (16): 1730-1737.
11. Holik M.F. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis //Am J Clin Nutr., 2004; 79 (3): 362-371.
12. Holik M.F. Vitamin D deficiency // New Engl J Med., 2007; 357: 266-281.
13. Forman J.P., Giovannucci E., Holmes M.D. et al. Plasma 25-hydroxyvitamin D level and risk of incidents hypertension //Hypertension, 2007; 49:1063-1069.
14. Vervloet M.G., Twisk J.W.R. Mortality reduction by vitamin D receptor activation in end-stage renal disease: a commentary on the robustness of current data //Nephrol Dial Transplant. 2009; 24:703-706.