Журнал «Травма» Том 9, №2, 2008
Вернуться к номеру
Цитокиновая иммунорегуляция репаративной регенерации костной ткани культивированными мезенхимальными стволовыми клетками
Авторы: Д.А. Зубов, В.М. Оксимец - Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины, Донецкий национальный медицинский университет им. М. Горького, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
В статье обсуждаются результаты исследований цитокинового профиля некоммитированных и остеоиндуцированных мезенхимальных стволовых клеток костного мозга человека in vitro. Обговаривается роль этих клеток в иммунорегуляторных процессах, протекающих при посттравматическом заживлении дефектов кости.
У статті обговорюються результати досліджень цитокінового профілю некомітованих та остеоіндукованих мезенхімальних стовбурових клітин кісткового мозку людини in vitro. Обговорюється роль цих клітин в імунорегуляторних процесах, що мають місце при посттравматичному загоєнні кісткових дефектів.
In the article the results of human bone marrow uncommitted and osteogenic inducted mesenchymal stem cell investigations in vitro on a cytokine profile are discussed. The role of these cells in immunoregulatory processes during post-traumatic bone defect healing is highlighting.
мезенхимальные стволовые клетки, цитокины, остеогенная индукция, щелочная фосфатаза, костная резорбция, остеорепарация
мезенхімальні стовбурові клітини, цитокіни, остеогенна індукція, кісткова резорбція, остеорепарація
mesenchymal stem cells, cytokines, osteogenic induction, bone alkaline phosphatase, bone resorption, bone reparation
Основной функцией остеобласта является его участие в физиологической и репаративной регенерации костной ткани – остеогенезе. Последний характеризируется вовлечением и пролиферацией остеопрогениторных клеток. Клеточными источниками, обеспечивающими процессы остеогенеза, являются активно пролиферирующие малодифференцированные клетки-предшественники. К ним относятся мезенхимальные (стромальные) стволовые клетки (МСК), локализованные в строме костного мозга и экстраскелетных кроветворных органах [20], остеогенные клетки внутреннего слоя периоста, клеточные элементы каналов остеонов и эндоста и периваскулярные клетки [2-4]. Эти клетки после остановки клеточного размножения дифференцируются в функционирующие остеобласты/остеоциты, ответственные за синтез и минерализацию костного матрикса. Зрелые остеобласты характеризуются определенными маркерами дифференциации, такими как щелочная фосфатаза (ЩФ), коллаген I типа, остеопонтин (ОП), трансформирующий фактор роста бета (TGFβ), фибронектин, остеокальцин и костный сиалопротеин [23].
Любой раневой (репаративный) процесс претерпевает ряд классических стадий, представляющих собой серию комплексных событий, таких как хемотаксис, митоз, васкуляризация, синтез компонентов экстрацеллюлярного матрикса (ЭЦМ) и его организация [11]. При остеорепаративных процессах, наряду с вышеперечисленными стадиями, принято выделять стадию формирования и реорганизации костного регенерата [6, 8, 9]. Контроль большинства событий, развивающихся в течение раневого процесса, осуществляется посредством растворимых медиаторов (ростовые факторы, цитокины, матриксные металлопротеиназы и др.), которые оказывают влияние на различные клеточные типы [11, 13, 16]. При остеорепаративных процессах воздействие этих медиаторов направлено на МСК, остеобласты, эндотелиоциты, клетки лимфоидного и миелоидного ростков, а также клетки моноцитарно-макрофагального ряда. В костной ране остеорепаративные процессы запускаются повреждающим фактором (механическое воздействие, некротизация участков костной ткани), который приводит к разрушению клеточных мембран и запуску четырех перекрывающихся, но четко определенных фаз – гемостаза, воспаления, пролиферации и ремоделирования [6].
В последнее время в зарубежной литературе начали появляться единичные работы, посвященные изучению цитокинового профиля, продуцируемого МСК и остеобластоподобными клетками [29]. Все больший интерес исследователи стали проявлять к пониманию возможных механизмов цитокиновой регуляции процессов физиологической и репаративной регенерации костной ткани. Недавно было показано, что антигенный фенотип остеобластоподобных клеток, их способность фагоцитировать частицы различной природы и размеров и их способность стимулировать аллогенные Т-клетки свидетельствует о наличии взаимодействий между остеобластоподобными клетками и клетками других популяций, с которыми они могут разделять некоторые общие иммунные функции. Свою иммунорегуляторную функцию остеобластоподобные клетки могут реализовывать через экспрессируемые ими ИЛ-4, ИЛ-12, ИЛ-15, ИЛ-18 и γ-интерферон [29]. В литературе имеются данные о том, что остеобласты можно отнести в функциональном плане к фолликулярным дендритическим клеткам на основании общности поверхностных антигенов обеих популяций [29]. Изучение роли МСК как потенциально активных индукторов иммунорегуляции репаративных процессов в костной ране является весьма актуальным и имеет немаловажное теоретическое и практическое значение для дальнейшего изучения остеорепарации и оптимизации технологий трансплантации МСК. К тому же первичные клинические исследования показали, что трансплантация культивированных некоммитированных МСК пациентам с длительно несрастающимися переломами костей нижних конечностей оказалась весьма эффективной, дала хорошие результаты [5] и в то же время вскрыла ряд проблем, поиску решений которых посвящена данная работа.
Целью настоящих исследований являлось определение функционального статуса некоммитированных и остеоиндуцированных МСК посредством изучения количественной продукции цитокинов следующего профиля: ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8 и ФНО-α (фактор некроза опухолей альфа).
Материал и методы
МСК изолировали по общепринятой методике [24] из аспирата костного мозга, забранного на гепарине, при пунктировании грудины или гребня подвздошной кости у пациентов травматологического профиля. Среднее количество аспирата составляло 20 мл от одного больного. Мононуклеарную фракцию аспирата высевали на проколлагененные пластиковые флаконы площадью 75 см2 (Corning, США) и культивировали в ростовой среде DMEM/F12 (Sigma, США) с добавлением 10% эмбриональной телячьей сыворотки (Биолот, Россия) и 1 нг/мл основного фактора роста фибробластов (Sigma, США) в СО2-инкубаторе (Jouan, Франция) при температуре 37°С в атмосфере с 5% содержанием СО2. При пассировании культур использовали 0,25% раствор трипсина и ЭДТА (Биолот, Россия) в соотношении 1:5. Остеоиндукцию линий МСК осуществляли путем внесения в выше указанную ростовую среду остеогенной добавки: 0,1 μМ дексаметазона, 10 мМ β-глицерофосфата и 50 мкг/мл аскорбиновой кислоты (Sigma, США).
Мета-аналитические данные по интерлейкиновой продукции были взяты из исследований, проведенных на культурах мононуклеаров периферической крови (МН ПК) здоровых доноров. МН ПК – это гетерогенные популяции одноядерных клеток, мигрирующих в циркуляторное русло из костного мозга. Они включают как субстрат-независимые ранние популяции гемопоэтических стволовых клеток (ГСК), так и адгерентные к пластику мало дифференцированные популяции МСК [17, 30].
Окраску культур на щелочную фосфатазу проводили иммуноцитохимическим методом с применением субстрата BCIP/NBT Liquid Substrate System (Sigma, США) согласно инструкции.
Количественное определение цитокинов в клеточных супернатантах проводили с помощью метода твердофазного сэндвича - BD OptEIA Human ELISA (производитель - BD Biosciences, США). Измерения проводились по оптической плотности полученного раствора с использованием фотометра для многофункционального анализа Synergy HT Bio-Tek Instruments и программы КС4 System (США).
Измерение концентрации цитокинов в культурах осуществляли согласно схемы: некоммитированные МСК 1-2 пассажей – сбор супернатанта производили на первые (n=30), третьи (n=30) и пятые (n=30) сутки; остеоиндуцированные МСК 1-2 пассажей – на десятые (n=30), тринадцатые (n=30), шестнадцатые (n=30) и девятнадцатые (n=30) сутки культивирования.
Визуализацию и фотодокументирование культур производили посредством инвертированного микроскопа Leica DMIL, рабочей станции по обработке изображений Leica QWin500 Standart и видеокамеры Sanyo TK-C1380 (Германия).
Полученные данные были выражены как среднее значение со стандартной ошибкой среднего и статистически проанализированы с помощью t-критерия Стьюдента.
Результаты и обсуждение
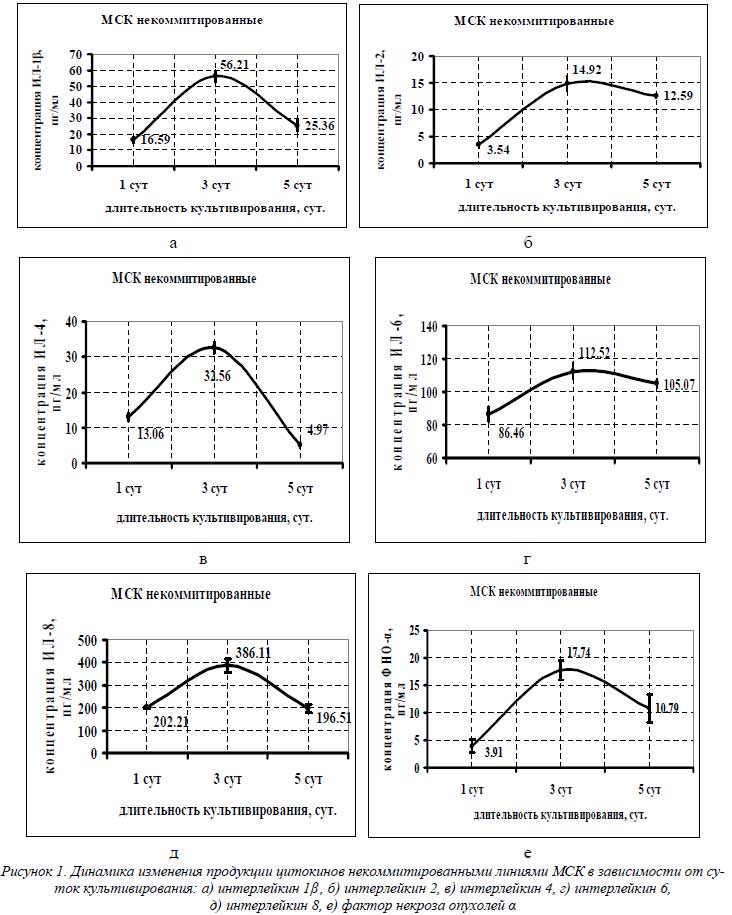
На рисунке 1 представлены графики, отражающие динамику изменения концентрации цитокинов в супернатантах некоммитированных культур МСК.
Из графиков видно, что максимальная концентрация цитокинов обнаруживалась в супернатантах некоммитированных культур, собранных после трех суток культивирования: ИЛ-1β – 56,21 пг/мл, ИЛ-2 – 14,92 пг/мл, ИЛ-4 – 32,56 пг/мл, ИЛ-6 – 112,52 пг/мл, ИЛ-8 – 386,11 пг/мл и ФНО-α – 17,74 пг/мл. Концентрации цитокинов из суточного супернатанта еще не достигали значений трехсуточного, а кондиционированная среда, не сливаемая с культур в течение 5 суток культивирования, уже показывала снижение концентраций во всем цитокиновом спектре некоммитированных МСК. Уровень секреции цитокинов некоммитированными МСК нами был принят за базовый при данных условиях культивирования.
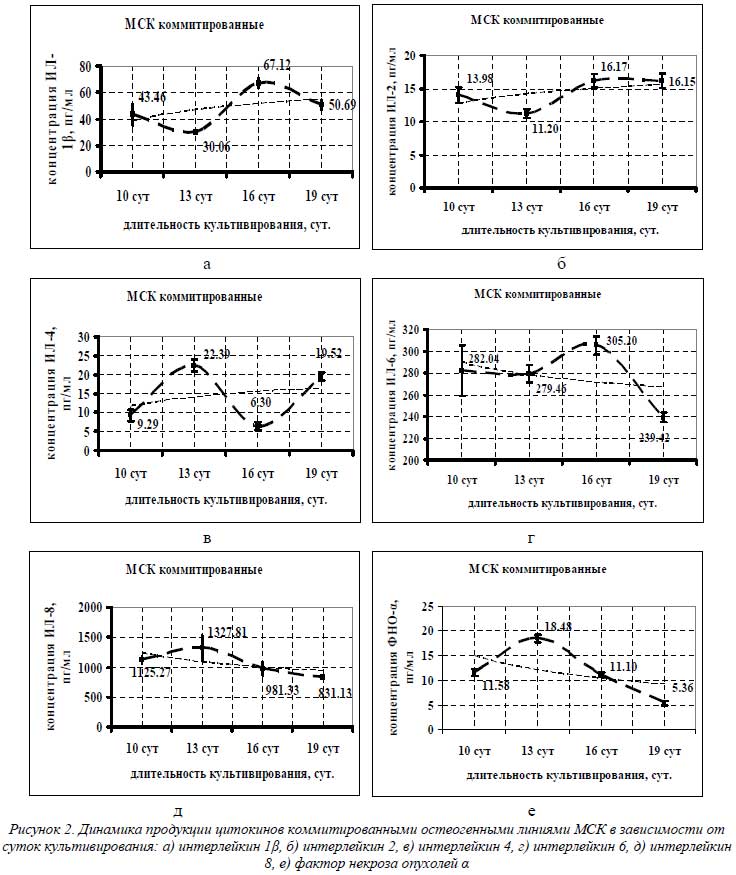
Определение концентрации цитокинов в супернатантах культур остеоиндуцированных МСК осуществляли в трехсуточных сливах на 10-е, 13-е, 16-е и 19-е сутки индукции (рис. 2). Выбор данных сроков был обусловлен особенностями технологии остеоиндукции МСК.
Как видно из графиков на рисунке 2, четкой линейной зависимости в уменьшении или увеличении секреции цитокинов МСК в зависимости от суток культивирования не наблюдалось. Однако при аппроксимации и сглаживании полученных кривых можно выявить тенденцию в цитокиновой продукции. Так, для ИЛ-1β, ИЛ-2 и ИЛ-4 (рис. 2 а-в) наблюдалась тенденция к увеличению секреции с 10-х по 19-е сутки индукции, а для ИЛ-6, ИЛ-8 и ФНО-α – к снижению (рис. 2 г-е).
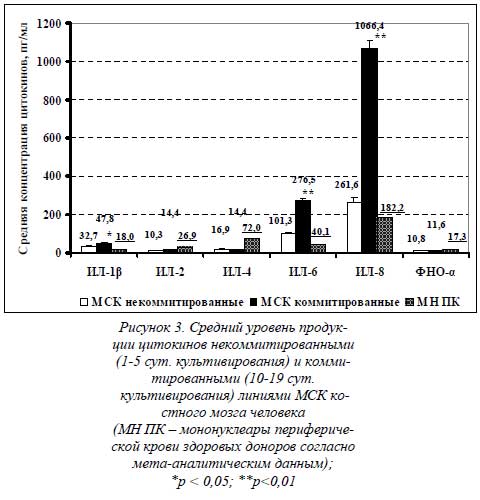
На рисунке 3 приведена сравнительная диаграмма среднего уровня секреции цитокинов некоммитированными (1-5-е сутки культивирования) и коммитированными (10-19-е сутки остеогенной индукции) линиями МСК. В качестве третьего столбца приведены значения концентраций цитокинов, измеренных в нестимулированных клеточных культурах мононуклеаров периферической крови здоровых доноров (согласно данным мета-анализа зарубежных исследований).
Представленные данные свидетельствуют о том, что уровень ИЛ-6 (101,3 пг/мл – некоммитированные МСК и 276,5 пг/мл – остеоиндуцированные МСК) и ИЛ-8 (261,6 пг/мл и 106,6 нг/мл соответственно) в обеих группах значительно выше, чем всех остальных измеряемых цитокинов, и цитокинов группы МН ПК. Продукция ИЛ-6 остеоиндуцированными линиями в 2,7 раза больше, чем некоммитированными, и почти в 7 раз выше, чем в культурах МН ПК здоровых доноров.
Но секреция ИЛ-6 некоммитированными МСК также больше, чем в группе МН ПК, в 2,5 раза. Подобным образом, продукция ИЛ-8 коммитированными линиями в 4 раза больше, чем некоммитированными, и почти что в 6 раз выше, чем в культурах МН ПК здоровых доноров. Секреция ИЛ-8 некоммитированными МСК также больше, чем в группе МН ПК, в 1,5 раза.
Уровень провоспалительного ИЛ-1β, как видно из диаграммы, также выше в коммитированной группе (47,8 пг/мл). Его продукция остеоиндуцированными линиями в 1,5 раза больше, чем некоммитированными (32,7 пг/мл), и в 2,7 раз выше, чем в культурах МН ПК здоровых доноров. Секреция ИЛ-1β некоммитированными МСК также больше, чем в группе МН ПК, почти в 2 раза.
По уровню секреции остальных цитокинов значительных различий не получено. Но сам факт секреции обеими группами МСК такого широкого цитокинового профайла уже сам по себе примечателен. Единственно, концентрация противовоспалительного ИЛ-4 значительно ниже в супернатантах некоммитированных (16,9 пг/мл) и коммитированных (14,4 пг/мл) культур, чем в группе МН ПК здоровых доноров. Более того, секреция МСК ИЛ-1β (в отличие от ИЛ-1α) и ИЛ-2 впервые показана в настоящих исследованиях. В зарубежной литературе данные по их секреции остеобластами или МСК отсутствуют.
Как указывалось выше, понимание иммунорегуляторных механизмов воздействия культивированных МСК на процессы остеорепарции имеет важное теоретическое и клиническое значение.
Известно, что биологической сущностью воспалительной реакции, развивающейся в ответ на травму, является создание условий для немедленной элиминации некротизированных клеток и создания условий для собственно репаративных процессов. Поэтому в начале первой стадии посттравматической регенерации все регуляторные процессы направлены на развитие воспаления в очаге повреждения. В связи с тем, что скорость репарации кости зависит от интенсивности деструкции поврежденных клеток и высвобождения остеоиндуктивных факторов, на заживление костной раны значительное влияние оказывает соотношение между индуктивными и ингибирующими факторами, которые выделяются из поврежденных клеток и синтезируются жизнеспособными клетками. В течение следующей фазы, собственно репарации, иммунорегуляторные процессы направлены на создание условий для восстановления целостности костной ткани, что сопряжено с процессами пролиферации и последующей дифференцировки клеточных источников остеорепарации [21]. Исходя из этого, нами был проведен анализ полученных результатов.
Цитокиновая регуляция процессов воспаления и костной перестройки
Согласно данным наших исследований, основными провоспалительными цитокинами, которые МСК могут секретировать в рану, являются ФНО-α, ИЛ-1β, ИЛ-6 и ИЛ-8. Эти же цитокины являются ключевыми и в процессах, регулирующих метаболизм и перестройку костной ткани [28, 32]. В течение первой стадии остеорепарации ФНО-α, ИЛ-1β, ИЛ-6 и ИЛ-8 привлекают в очаг повреждения нейтрофилы и моноциты/макрофаги и усиливают их адгезию к клеткам эндотелия в очаге повреждения, чем создают условия для гуморально-клеточной кооперации крови и костной ткани и развития воспалительной реакции [10, 15]. Макрофаги, в свою очередь, активируются напрямую посредством лиганд-рецепторного взаимодействия (IL-6R/IL-6) и дифференцируются в зрелые остеокластные поликарионы, способные резорбировать костную ткань [27, 28]. Кроме того, ФНО-α и ИЛ-1β аутокринно регулируют процессы пролиферации/дифференциации МСК/остеобластов в ране [27]. Последние, в ответ на аутокринный стимул, начинают вырабатывать коллагеназы и протеазы, которые также принимают участие в резорбции некротизированных участков кости. Вдобавок оба этих интерлейкина стимулируют выработку остеобластами ИЛ-6 и ИЛ-8 [32].
Согласно нашим исследованиям, продукция ИЛ-6 и ИЛ-8 МСК многократно повышается как в процессе пролиферации, так и в процессе дифференцировки (см. рис 3). Это повышение обусловлено как паракринным, так и аутокринным воздействием ФНО-α и ИЛ-1β на МСК. Кроме того, ФНО-α также по аутокринному механизму, стимулирует остеобласты к выработке RANKL лиганда, который является ключевым участником гетерофильного межклеточного взаимодействия «остеобласт-предшественник остеокласта» (RANKL/ RANK соответственно) [25, 31]. Именно такое взаимодействие способствует созреванию остеокласта и продукции им всего арсенала матриксных белков и матриксных металлопротеаз, участвующих в процессах остеолиза костной ткани [27]. ФНО-α и ИЛ-1β также способствуют хемотаксису эндотелиоцитов в место воспаления, что в свою очередь приводит к инициации ангиогенеза в месте повреждения [19]. Это свидетельствует о том, что МСК через продуцируемых ими ФНО-α и ИЛ-1β способствуют процессам восстановления кровообращения в очаге повреждения, а также, возможно, за счет формирования микроокружения с привлеченными в очаг повреждения эндотелиоцитами, дифференцируются в ангиогенном направлении.
Противовоспалительный ИЛ-4 за счет подавления секреции предшественниками остеокластов агентов воспаления ФНО-α и ИЛ-1β оказывает ингибирующее влияние на процессы костной резорбции и миграции остеокластов [22, 29]. Но продукция ИЛ-4 МСК в обеих группах по сравнению с отдельной и суммарной секрецией всех остальных изученных нами провоспалительных цитокинов незначительна.
Функциональная кооперация МСК/остеобластов и лимфоцитов посредством цитокинов
ФНО-α, ИЛ-1β, ИЛ-6 и ИЛ-8 также вносят свой вклад в процессы кооперации лимфоцитов и МСК как предшественников остеобластов. Так, ИЛ-1β, воздействуя на эндотелий, увеличивает его проницаемость для клеток крови и способствует притоку последних в очаг воспаления и раневого заживления. Он же способствует дегрануляции тучных клеток, что ведет к повышению проницаемости сосудистой стенки и привлечению в зону травмы клеток белой крови, прежде всего лимфоцитов и моноцитов, обеспечивающих течение воспалительного процесса [34]. ИЛ-8 усиливает хемотаксис лейкоцитов в очаг воспаления [14], а ИЛ-6 стимулирует пролиферацию клеток гранулоцитарного и макрофагального ряда, дифференциацию В-клеток и созревание мегакариоцитов [26]. ФНО-α и ИЛ-1β оказывают стимулирующее воздействие на пролиферацию/дифференциацию лимфоидного ростка ГСК. Вследствие этих процессов концентрация В-, Т-лимфоцитов и моноцитов в очаге повреждения/воспаления повышается, что ведет к активация тимуса и паратиреоидной системы – системных факторов регуляции остеорепарации [7]. Наряду с регуляцией системных факторов остеорепарации МСК через увеличение количества В-, Т-лимфоцитов и моноцитов оказывает воздействие и на местные регуляторные факторы воспалительной фазы репаративного остеогенеза [1].
В наших исследованиях впервые был отмечен факт секреции обеими группами МСК ИЛ-2. Основным результатом действия ИЛ-2 на покоящиеся или стимулированные антигеном или митогеном иммунокомпетентные клетки является обеспечение их пролиферации. Именно эта биологическая активность ИЛ-2 определяет его в качестве типичного ростового фактора клеток лимфо-миелоидного ряда [35]. Мишенями регуляторного действия ИЛ-2 являются различные субпопуляции Т-клеток, В-клетки, натуральные киллерные клетки, макрофаги. Все они имеют соответствующий рецептор для восприятия сигнала от ИЛ-2 [12, 33]. Перечисленные эффекты ИЛ-2 на иммунокомпетентные клетки свидетельствуют о возможном участии МСК в процессах иммунного ответа и активации В- и Т-лимфоцитов, стимуляции пролиферации лимфоидных и миелоидных линий ГСК, а также активации звена неспецифического иммунитета в виде пролиферации предшественников нейтрофилов, натуральных киллеров и цитотоксических Т-лимфоцитов. Эти клеточные популяции привлекаются в очаг повреждения и под воздействием ФНО-α, ИЛ-1β и ИЛ-8 [27], которые также секретируются МСК.
ИЛ-4 стимулирует секрецию Т-клетками ИЛ-2 и активирует экспрессию В-клетками молекул главного комплекса гистосовместимости I и II классов [27]. Также этот противовоспалительный цитокин регулирует синтез ИЛ-6, ИЛ-8 и LIF (leukemia inhibitory factor) человеческими МСК [18]. При кооперации данного цитокина с ИЛ-1 происходит стимуляция пролиферации мегакариоцитарного ростка; с эритропоэтином – эритроидного ростка; с гранулоцит-колониестимулирующим фактором – моноцитарного и гранулоцитарного ростков [22].
Выводы
Обобщая изложенный в данной работе материал, можно говорить о том, что МСК в процессе пролиферации и ранней дифференцировки продуцируют преимущественно провоспалительные интерлейкины ФНО-α, ИЛ-1β, ИЛ-6 и ИЛ-8, которые регулируют развитие воспалительных процессов в очаге повреждения, привлечение костных макрофагов (остеокластов), резорбцию некротизированных участков костной ткани. Это способствует созданию условий для прикрепления МСК/остеобластов к жизнеспособной костной ткани и формированию остеонов. Продукция МСК противовоспальтельного ИЛ-4, вероятнее всего, выполняет сдерживающую регуляторную функцию, которая направлена на ингибирование воспалительных и остеорезорбирующих процессов. Соотношение провоспалительных и противовоспалительных цитокинов на ранних этапах дифференцировки МСК смещается в сторону превалирования провоспалительных цитокинов. Возможно, что в процессе дальнейшей (поздней) дифференцировки МСК в остеобласты соотношение провоспалительных и противовоспалительных цитокинов будет смещаться в сторону увеличения противовоспалительных факторов. Помимо участия МСК в иммунорегуляции воспалительных процессов посредством секреции ФНО-α, ИЛ-1β, ИЛ-6 и ИЛ-8, эти клетки способствуют функциональной кооперации МСК/остеобластов и лимфоцитов, а посредством секреции ИЛ-2 и ИЛ-4 МСК активируют В- и Т-лимфоциты и стимулируют пролиферацию лимфоидных и миелоидных линий ГСК.
Таким образом, МСК посредством поверхностной экспрессии различных функциональных молекул и цитокиновой продукции могут являться мощными и эффективными активаторами костной резорбции, воспаления и иммунного ответа в процессе посттравматической остеорепарации костной ткани, особенно в тех случаях, когда последний имеет тенденцию к хронизации и «замирает» в воспалительной или пролиферативной фазе.
- Астахова В.С. Принципи імунокоригуючої терапії хворих на остеомієліт // Посібник з актуальних проблем кістково-гнійної хірургії та методів консервативного лікування. – 2-е видання. – К., 1999. – С. 358-372.
- Гололобов В.Г., Деев Р.В. Стволовые стромальные клетки и остеобластический клеточный дифферон // Морфология (Morphology). – 2003. – Т. 123, №1. – С. 9-19.
- Илизаров Г. А., Палиенко Л. А., Шрейнер А. А., Богомягков B.C. Динамика численности костномозговых клеток, образующих колонии фибробластов в культуре, и ее связь с активностью остеогенеза при репаративной регенерации в условиях удлинения конечности // Онтогенез. – 1983. – Т. 14, № 6. – С. 617-623.
- Илизаров Г.А., Швед С.И., Мальцева Л.В. О роли костного мозга в консолидации переломов // Травматология и ортопедия России. – 1994. – № 2. – С. 158-161.
- Казаков В.Н., Климовицкий В.Г., Гринь В.К., Пастернак В.Н., Оксимец В.М., Попандопуло А.Г., Зубов Д.А. Трансплантация остеогенных клеток в ортопедии и травматологии // Журнал академії медичних наук України. – Т. 12, №2. – 2006. – С. 229-241.
- Корж А.А., Белоус А.М., Панков Е.Я. Репаративная регенерация кости / АМН СССР. – М.: Медицина, 1972. - 232 с.
- Корж Н.А., Дедух Н.В. Репаративная регенерация кости: современный взгляд на проблему. Стадии регенерации // Ортопедия, травматология и протезирование. – 2006. – № 1. – С. 77-84.
- Лаврищева Г.И., Оноприенко Г.А. Морфологические и клинические аспекты репаративной регенерации опорных органов и тканей. – М.: Медицина, 1996. – 208 с.
- Лиознер Л.Д., Сидорова В.Ф. Состояние процессов физиологической и репаративной регенерации // Журнал общей биологии. – 1975. – Т. 36, №2. – С. 237-242.
- Ханапияев У. Б., Азизов М. Ж, Байбеков И. М. Морфология региональных лимфатических узлов крыс при переломах костей голени и магнитолазерной терапии // Патология. - 2000. - № 4. - С. 42-45.
- Alberts B., Johnson A., Lewis .J, Raff M. et al. Cell junctions, cell adhesion, and the extracellular matrix. In: Molecular Biology of the Cell. - New York: Garland Science, 2002. - Р. 1065-1125.
- Bachmann M.F. and Oxenius A. Interleukin 2: from immunostimulation to immunoregulation and back again // EMBO Rep. – 2007. – Vol. 8, №12. – P. 1142-1148.
- Barrick B., Campbell E.J. and Owen C.A. Leukocyte proteinases in wound healing: roles in physiologic and pathological processes // Wound Repair Regen. - 1999. - Vol. 7. - P. 410-422.
- Binsky I., Haran M., Starlets D. et al. IL-8 secreted in a macrophage migration-inhibitory factor- and CD74-dependent manner regulates B cell chronic lymphocytic leukemia survival // Proc. Natl. Acad. Sci. USA. – 2007. – Vol. 104, №33. – P. 13408-13413.
- Bostrom M. and Asnis P. Transforming growth factor beta in fracture repair // Clin. Orthop. – 1998. – Vol. 355-S. – P. 124-131.
- Cook H., Davies K.J., Harding K.G. et al. Defective extracellular matrix reorganization by chronic wound fibroblasts is associated with alterations in TIMP-1, TIMP-2, and MMP-2 activity // J. Invest. Dermatol. - 2000. - Vol. 115. - P. 225-233.
- De Groote D., Zangerle P.F., Gevaert Y. and Fassotte M.F. Direct stimulation of cytokines (IL-1 beta, TNF-alpha, IL-6, IL-2, IFN-gamma and GM-CSF) in whole blood. I. Comparison with isolated PBMC stimulation // Cytokine. – 1992. – Vol. 4, №3. – P. 239-248.
- Denizota Y., Bessea A., Raherb S. et al. Interleukin-4 (IL-4), but not IL-10, regulates the synthesis of IL-6, IL-8 and leukemia inhibitory factor by human bone marrow stromal cells // Biochimica et Biophysica Acta (BBA)-Mol. Cell Res. – 1999. - Vol. 1449, №1. – P. 83-92.
- Di Peppe R.S., Mangoni A., Zambruno M.A. et al. Adenovirus-mediated VEGF (165) gene transfer enhances wound healing by promoting angiogenesis in CD1 diabetic mice // Gene Ther. - 2002. - Vol. 9, №19. - P. 1271-1277.
- Dominici M., Le Blanc K., Mueller I. et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement // Cytotherapy. – 2006. – Vol. 8, №4. – P. 315-317.
- Frost H.M. The Biology of Fracture Healing. An Overview for Clinicians. Part I // Clin. Orthop. Rel. Res. – 1989. – Vol. 248. – P. 283-293.
- Mangashetti L.S., Khapli S.M. and Wani M.R. L-4 inhibits bone-resorbing activity of mature osteoclasts by affecting NF-kappa B and Ca2+ signaling // J. Immunol. – 2005. – Vol. 175. – P. 917-925.
- Marie P.J. Osteoblasts and bone formation. In: Advances in organ biology: molecular and cellular biology of bone. – Stamford, CT (USA): JAI Press, 1999 – №5B. – P. 401-427.
- Minguell J.J., Erices A. and Conget P. Mesenchymal stem cells // Exp. Biol. Med. (Maywood). - 2001. – Vol. 226. – P. 507–520.
- Mundy G.R. Osteoporosis and inflammation // Nutr. Rev. – 2007. – Vol. 65, №12Pt 2. – P. 147-151.
- Mysliwiec J., Zbucki R., Winnicka M. et al. Interleukin-6 is not essential for bone turnover in hypothyroid mice // Folia Histochem. Cytobiol. – 2007. – Vol. 45, №4. – P. 387-392.
- Roodman G.D. Role of cytokines in the regulation of bone resorption // Calcif. Tissue Int. – 1993. – Vol. 53, №1. – P. 94-98.
- Rougier F., Cornu E., Praloran V. and Denizot Y. IL-6 and IL-8 production by human bone marrow stromal cells // Cytokine. - 1998. - Vol. 10, №2. – P. 93-97.
- Ruiz С., Pérez Е., García-Martínez О. et al. Expression of cytokines IL-4, IL-12, IL-15, IL-18, and IFNγ and modulation by different growth factors in cultured human osteoblast-like cells // J. Bone Miner. Metab. – 2007. – Vol. 25, №5. - Р. 286-292.
- Silberer J., Ihorst G. and Kopp M.V. Cytokine levels in supernatants of whole blood and mononuclear cell cultures in adults and neonates reveal significant differences with respect to interleukin-13 and interferon-gamma // Pediatr. Allergy Immunol. – 2008. – Vol. 19, №2. – P. 140-147.
- Takayanagi H., Ogasawara K., Hida S. et al. T cell mediated regulation of osteoclastogenesis by signaling cross-talk between RANKL and IFN-γ // Nature. - 2000. – Vol. 408. – P. 600-605.
- Tani-Ishii N., Tsunoda A., Teranaka T. and Umemoto T. Autocrine regulation of osteoclast formation and bone resorption by IL-1 alpha and TNF alpha // J. Dent. Res. – 1999. – Vol. 78. – P. 1617-1623.
- Turka L.A. and Walsh P.T. IL-2 signaling and CD4+ CD25+ Foxp3+ regulatory T cells // Front. Biosci. – 2008. – Vol. 1, №13. – P. 1440-1446.
- Vichnick D. Fracture healing /A basic science primer in Orthopaedics / Ed. by F. Bronner, R. Worrel. – Williams & Wilkins, 1991. – 253 p.
- Watson C.L., Furlong S.J. and Hoskin D.W. Impaired interleukin-2 synthesis and T cell proliferation following antibody-mediated CD3 and CD2 or CD28 cross-linking in trans: evidence that T cell activation requires the engagement of costimulatory molecules within the immunological synapse // Immunol. Invest. – 2008. – Vol. 37, №1. - P. 63-78.