Газета «Новости медицины и фармации» 15 (425) 2012
Вернуться к номеру
Симпозиум 93 «Подагра»
Авторы: А.И. Дядык, А.Л. Христуленко, Е.Л. Стуликова, И.И. Здиховская, Н.В. Мальцева - Донецкий национальный медицинский университет им. М. Горького
Версия для печати
Проводит: Донецкий национальный медицинский университет им. М. Горького.
Рекомендован: ревматологам, травматологам, терапевтам, семейным врачам.
Определение
Подагра — хроническое системное метаболическое заболевание, характеризующееся нарушением обмена пуринов (гиперурикемия), ведущее к отложению кристаллов моноурата натрия (МУН) в различных тканях, что проявляется кристаллиндуцированным воспалением в местах фиксации уратов (суставы, периартикулярные ткани, внутренние органы).
Эпидемиология
Распространенность подагры в Европе составляет у взрослого населения 1–2 %, а у лиц старше 50 лет — 6 %. Частота подагры в ряде регионов Украины — 400 на 100 000 взрослого населения. В последние два-три десятилетия наблюдается отчетливое нарастание ее распространенности. Существенно чаще подагрой болеют мужчины (по различным данным, соотношение м : ж от 7 : 1 до 19 : 1). В ряде эпидемиологических исследований показано, что частота подагры у мужчин и женщин в возрасте старше 60 лет эквивалентна.
Пик заболеваемости наблюдается в 40–50 лет у мужчин и в 60 лет и старше — у женщин.
Этиология
Персистирующая гиперурикемия (повышенные сывороточные уровни мочевой кислоты) — облигатный фактор риска развития подагры. Европейская противоревматическая лига (EULAR) рекомендует оценивать уровни мочевой кислоты в крови выше 360 мкмоль/л как гиперурикемию. Формирование кристаллов МУН и их депозиция в ткани происходит при супернасыщении сыворотки крови уратами (т.е. при уровне мочевой кислоты более 420 мкмоль/л).
К факторам риска развития подагры относят возраст: у мужчин младше 35 лет распространенность подагры менее 0,5 % и более 7 % — в возрасте старше 75 лет. У женщин в пременопаузе подагра развивается редко, но в возрасте 75 лет и старше распространенность подагры достигает 2,5–3 %.
Позднее развитие подагры у женщин может быть связано с урикозурическими эффектами эстрагенов.
Риск развития подагры повышается при ожирении в 4 раза по сравнению с лицами, имеющими индекс массы тела 21–25 кг/м2.
Чрезмерное ежедневное употребление мяса повышает риск развития подагры на 20 %.
У лиц, ежедневно употребляющих >50 г алкоголя, частота развития подагры в 2,5 раза выше, чем у таковых, не употребляющих алкоголь.
Применение лекарственных препаратов (чаще диуретиков) ассоциируется с повышением уровней уратов сыворотки крови. Однако в ряде исследований такая ассоциация ставится под сомнение, а повышение значений мочевой кислоты у лиц с артериальной гипертензией (АГ) и сердечной недостаточностью (СН), получающих диуретики, связано с неблагоприятным влиянием АГ и СН на пуриновый обмен. Особенности механизмов почечной экскреции уратов при применении различных диуретиков неоднозначны. Риск развития гиперурикемии и подагры выше при использовании более мощных петлевых диуретиков, чем менее потентных тиазидовых.
Циклоспорин, аспирин и салицилаты снижают экскрецию уратов и способствуют развитию гиперурикемии. К развитию гиперурикемии также приводят метаболический синдром, АГ и СН.
Патогенез
Для формирования кристаллов МУН необходимо наличие высокого уровня мочевой кислоты в сыворотке крови. В норме устойчивый уровень мочевой кислоты в крови является результатом баланса между ее продукцией и экскрецией. Гиперурикемия развивается при увеличении продукции мочевой кислоты и/или нарушении ее экскреции (в основном почечной). Ураты являются конечным продуктом метаболизма пуриновых нуклеотидов, составных клеточной энергии — АТФ, ДНК и РНК.
Повышенная продукция уратов, приводящая к развитию гиперурикемии и подагры, может быть обусловлена энзиматическими дефектами, а также следствием увеличения деструкции клеток (малигнантность, полицитемия vera, гемолитическая анемия).
2/3 уратов экскретируется почками, а остальная часть — кишечником. Представлены доказательства, что 85–95 % случаев подагры являются результатом нарушения выведения уратов почками.
Гиперурикемия является ведущим базисным патогенетическим механизмом подагры и основным фактором риска ее развития.
Ниже показана частота развития подагры в зависимости от уровня мочевой кислоты в сыворотке крови (табл. 1).
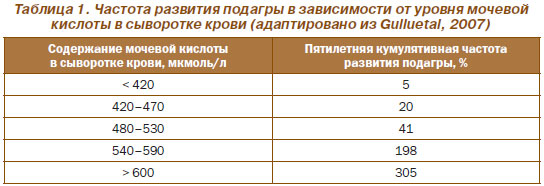
Развитие подагрического воспаления обусловлено сложным влиянием различных типов клеток на депозицию кристаллов МУН в суставах, что обусловливает нарушение баланса между синтезом провоспалительных и противовоспалительных маркеров.
Основной механизм развития острого и хронического подагрического артрита — отложение кристаллов уратов в суставы и периартикулярные ткани, взаимодействие которых с синовиацитами, моноцитами, макрофагами, нейтрофилами, остеобластами ведет к синтезу широкого спектра провоспалительных цитокинов: интерлейкина-1 (ИЛ-1), интерлейкина-6, фактора некроза опухоли α, хемокинов, метаболитов арахидоновой кислоты, супероксидных кислородных радикалов, протеиназ, которые наряду с кининами, компонентами комплемента и гистамином индуцируют воспаление суставов и периартикулярных тканей, а также системные реакции.
Среди клеток, участвующих в развитии подагрического воспаления, особое место отводится нейтрофилам, выраженная инфильтрация которыми синовиальной ткани рассматривается как ведущий фактор подагрического артрита. Взаимодействие между лейкоцитами и эндотелиальными клетками сосудов — ключевой этап развития подагрического воспаления.
Особенностью острого подагрического артрита является его самоограничивающий характер, что в определенной мере связывают с синтезом уратами ряда противовоспалительных медиаторов (в частности, трансформирующего фактора роста).
Гистопатология
Отложение кристаллов МУН имеет место в хрящах, сухожилиях, синовиальной жидкости и подкожной ткани. Аваскулярность соединительной ткани (особенно хрящей) рассматривается как ведущий фактор, предрасполагающий к депозиции кристаллов. Наиболее ранние артикулярные изменения являются результатом депозиции кристаллов МУН. Тофусы могут быть интер-, пери- и экстраартикулярными. Подагрические тофусы представляют собой гранулемы, состоящие из моно- и мультинуклеарных макрофагов, окружающих депозиты кристаллов МУН. В тофусах представлено несколько зон, включающих центральную, состоящую из кристаллов МУН, окруженных клеточной венечной зоной, в которой выявляется большое количество макрофагов и плазматических клеток. Эта венечная зона разделяет центральный отдел депозитов кристаллов МУН от окружающей фиброваскулярной зоны.
Гранулематозный процесс в костях и суставах ведет к развитию эрозий, костной редукции и подагрического артрита. Депозиция кристаллов МУН часто ассоциируется с сопутствующим остеоартрозом.
Диагностика подагры
Для постановки диагноза подагры используются критерии, разработанные S. Wallace и соавт. (1997), утвержденные ВОЗ в 2000 г.
Классификационные критерии острого подагрического артрита
1. Выявление характерных кристаллов МУН в суставной жидкости.
2. Наличие тофусов, содержащих кристаллы МУН.
3. Наличие 6 из 12 перечисленных ниже признаков:
— более одной атаки острого артрита в анамнезе;
— максимальное воспаление сустава в первый день болезни;
— моноартрит;
— гиперемия кожи над пораженным участком;
— припухание, боль в первом плюснефаланговом суставе;
— одностороннее поражение первого плюснефалангового сустава;
— одностороннее поражение суставов стопы;
— подозрение на тофусы;
— гиперурикемия;
— асимметричный отек суставов;
— субкортикальные кисты без эрозий;
— отрицательные результаты при посеве синовиальной жидкости.
Диагноз подагры считается окончательным при подтверждении наличия кристаллов МУН в синовиальной жидкости или в тофусах с помощью поляризационной микроскопии. Наличие 6 из 12 вышеперечисленных клинических проявлений позволяет с большим основанием заподозрить подагру.
II. Периоды:
а) преморбидный (доклинический);
б) интермиттирующий (остро рецидивирующий);
в) хронический.
III. Варианты течения:
а) легкое;
б) среднетяжелое;
в) тяжелое.
IV. Фаза:
а) обострения (активная);
б) ремиссии (неактивная).
V. Рентгенологические стадии поражения суставов:
I — крупные кисты (тофусы) в субхондральной кости и в более глубоких слоях, иногда уплотнение мягких тканей;
II — крупные кисты вблизи сустава и мелкие эрозии суставных поверхностей, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами;
III — большие эрозии не менее чем на 1/3 суставной поверхности, остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
VI. Периферические тофусы и их локализация:
а) имеются (где именно);
б) отсутствуют.
VII. Степень функциональной недостаточности:
0 — сохранена;
I — сохранена профессиональная способность;
II — утрачена профессиональная способность;
III — утрачена способность к самообслуживанию.
VIII. Подагрическая нефропатия.
Клиническая картина
Острый подагрический артрит
Классическая клиническая картина острого подагрического артрита характеризуется внезапным появлением и быстрым нарастанием интенсивных болей, как правило, в одном суставе, припухлостью, покраснением кожи над ним и нарушением функции. Приступ чаще развивается в ночное время или в ранние утренние часы, в начале заболевания продолжается 1–10 дней (при отсутствии адекватной терапии) и заканчивается полным выздоровлением с отсутствием каких-либо симптомов после приступа. Среди провоцирующих факторов острой атаки выделяют травму, большое количество мясной пищи (особенно в сочетании с алкоголем), хирургические вмешательства, прием диуретиков. Первая подагрическая атака часто проявляется поражением первого плюснефалангового сустава стопы.
У большинства больных развиваются повторные приступы подагры, в дальнейшем они учащаются, укорачиваются бессимптомные периоды, а артриты становятся затяжными. При отсутствии адекватной терапии (и нередко при ее проведении) наблюдается прогрессирование заболевания с вовлечением в патологический процесс других суставов и формированием тофусов.
У части больных острые атаки подагры носят атипичный характер и проявляются тендосиновиитом, бурситом или целлюлитом. У них наблюдаются легкие эпизоды дискомфорта в суставах в течение нескольких дней без их припухания. В 10 % атипичных атак поражается несколько суставов (иногда носящее мигрирующий характер). При этом преобладают системные проявления подагры (слабость, лихорадка).
Межприступные периоды
Между атаками на начальных этапах течения подагры наблюдаются бессимптомные периоды (в части случаев длительные). У некоторых больных атаки не повторяются, у других наблюдаются через нескольких лет. Однако у большинства пациентов повторные атаки развиваются в течение года после первой подагрической суставной атаки. В конечном итоге в результате повторных атак и персистирующей депозиции кристаллов МУН поражаются многие суставы, а болевой синдром носит хронический характер. Время от первой суставной атаки до персистирующей симптоматической картины заболевания колеблется от нескольких до 10 лет и более.
Хроническая тофусная подагра
Хроническому течению подагры присуще образование больших депозитов кристаллов (тофусов), локализующихся подкожно, внутрикожно и в других органах. Различной формы узлы формируются главным образом вокруг разгибательных поверхностей предплечий, на локтях, ушных раковинах, в области ахилловых сухожилий. Тофусы асимметричны по локализации и различны по размерам. В некоторых случаях тофусы могут достигать больших размеров, изъязвляться с выделением крошкообразной белой массы; возможны случаи локального воспаления (наличие эритемы, гноя). Тофусы могут локализоваться на веках, языке, гортани или в сердце (вызывая нарушение проводимости и дисфункцию клапанного аппарата).
Для хронической тофусной подагры характерно прогрессирующее поражение суставов (ограничение движений, деформация) с различной выраженностью синовиита (прежде всего в первых плюснефаланговых, голеностопных, межфаланговых суставах и в суставах кисти). Как и в случаях с тофусами, поражение суставов характеризуется асимметричностью. При хроническом течении атаки подагрического артрита протекают более мягко. На поздних стадиях заболевания (особенно при отсутствии адекватной терапии) возможно поражение тазобедренных, коленных, плечевых суставов, позвоночника и сакроилеальных сочленений.
Подагра ассоциируется с несколькими вариантами поражения почек, которые могут быть представлены как самостоятельно, так и в различных комбинациях. К ним относят:
— нефролитиаз, наблюдаемый значительно чаще при подагре, чем без таковой. Основу камней в большинстве случаев составляет мочевая кислота. Только у 10–20 % больных в составе камней обнаруживаются оксалаты или фосфат кальция. Уратные камни имеют белесоватый оттенок и обычно рентгенонегативны;
— уратную нефропатию, для которой характерно отложение МУН в интерстиции почек, что связывают с перманентными гиперурикемией, гиперурикозурией, кислой реакцией мочи и нарушением продукции аммония. Этот вариант поражения почек ассоциируется с высоким риском развития почечной недостаточности (ПН).
В 2006 г. опубликованы рекомендации EULAR, посвященные клинико-лабораторной диагностике больных подагрой, базирующиеся на результатах крупных контролируемых рандомизированных исследований (КРИ). Мы считаем уместным и полезным привести эти рекомендации.
Клинико-лабораторная характеристика больных подагрой (рекомендации экспертов EULAR, 2006)
1. При острых атаках быстро развиваются сильная боль в суставе (суставах), припухлость, выраженная эритема и повышенная чувствительность, которые достигают максимума в течение 6–12 часов, с выраженной эритемой, что довольно убедительно свидетельствует о кристаллическом воспалении (хотя и неспецифическом для подагры).
Таким образом, классическая клиническая картина является хорошим маркером острой атаки подагры. Однако для окончательного диагноза наряду с приведенными выше симптомами необходимо выявление кристаллов МУН, что является стандартом заболевания.
2. Приведенная клиническая картина характерна для подагры с гиперурикемией, но для подтверждения диагноза необходимо установление наличия кристаллов МУН.
3. Наличие кристаллов МУН в синовиальной жидкости или в аспирате тофусов наряду с клиническими проявлениями позволяет определенно установить диагноз подагры.
4. Таким образом, выявление кристаллов МУН является решающим маркером в диагностике симптоматической подагры. Исследование синовиальной жидкости на наличие кристаллов МУН должно проводиться при всех воспалительных артритах, т.к. в ряде случаев подагра может протекать атипично.
5. Идентификация кристаллов МУН из «бессимптомных суставов» позволяет диагностировать подагру в межприступном периоде.
6. Подагра и сепсис могут сосуществовать. Если подозревается септический артрит, то необходимо бактериологическое исследование синовиальной жидкости даже при наличии кристаллов МУН.
7. Хотя сывороточные уровни мочевой кислоты являются наиболее важным фактором риска, они не могут подтвердить или исключить наличие подагры, так как у многих лиц с гиперурикемией не развивается подагра, а в течение острых атак подагры сывороточные уровни мочевой кислоты могут быть нормальными.
8. У ряда больных с подагрой необходимо определение мочевой кислоты в моче, особенно в случаях семейной истории начала подагры (начала подагры ранее 25 лет) или при наличии нефролитиаза.
9. Хотя рентгенологическое исследование имеет важное значение в дифференциальной диагностике и может демонстрировать типичные признаки хронической подагры (субкортикальные кисты без эрозий), оно малоинформативно на ранних этапах заболевания или при острых атаках.
10. Факторы риска подагры или наличие коморбидности должны быть оценены, включая проявления метаболического синдрома (ожирение, гипергликемия, гиперлипидемия, АГ, а также СН и ПН) с целью проведения соответствующей терапии.
Дифференциальная диагностика
Подагру следует дифференцировать с сепсисом, который может сосуществовать с ней, а также с другими кристаллассоциированными синовиитами (прежде всего с депозицией пирофосфата кальция — особенно у лиц пожилого возраста), реактивными, псориатическим и ревматоидным артритами. Для постановки диагноза подагры необходимо исследование синовиальной жидкости на наличие инфекции (сепсис) или кристаллов пирофосфата кальция (пирофосфатная артропатия), или кристаллов МУН (подагра).
Лечебная тактика
Лечебная тактика при подагре определяется особенностями клинической картины, наличием системных проявлений, поражением внутренних органов и их тяжестью.
Цели лечения подагры включают:
— максимально быструю ликвидацию острой атаки подагры;
— превентирование рецидивов острой подагрической атаки;
— превентирование или ингибирование скорости развития заболевания и его осложнений;
— превентирование или устранение факторов, ассоциированных с подагрой и ухудшающих ее течение (ожирение, метаболический синдром, АГ, СН, ПН, гипертриглицеридемия, употребление большого количества мясной пищи, алкоголя и др.).
Лечебная тактика подагры включает немедикаментозные и медикаментозные подходы.
Немедикаментозные подходы:
— обучение больного (изменение образа жизни, диетический режим, исключение алкоголя, снижение массы тела при ожирении, отказ от курения, регулярный контроль уровня мочевой кислоты в крови);
— информирование о симптоматике острого подагрического артрита, обострении хронической подагрической артропатии и последствиях неконтролируемой гиперурикемии;
— обучение быстрому купированию подагрической суставной атаки (всегда иметь в кармане нестероидные противовоспалительные препараты (НПВП); отказ от аналгетиков);
— информирование о назначаемых лекарственных препаратах (дозировки, побочные эффекты, взаимодействие с другими лекарственными препаратами, назначаемых по поводу сопутствующих заболеваний).
Диетический режим
В последнее десятилетие проведено несколько крупных клинических исследований и опубликован ряд обзоров, посвященных влиянию различных пищевых продуктов на риск развития подагры, ее обострений и гиперурикемии.
В этих работах показано, что лишний вес, ожирение и употребление пива, крепких спиртных напитков (спирт, водка и др.), мяса, морских продуктов, фруктозы и напитков, содержащих сахар, являются факторами риска развития подагры и повышения уровня мочевой кислоты в сыворотке крови. Также идентифицированы протекторные факторы, включающие снижение лишней массы тела, употребление продуктов с низким содержанием жира, а также витамина С и кофе. Другие продукты являются нейтральными в отношении факторов риска развития подагры (вино, чай, диетические напитки, продукты с высоким содержанием жира и овощи с высоким содержанием пуринов).
Медикаментозная терапия
Характер медикаментозной терапии определяется особенностью клинического течения подагры, наличием экстраартикулярных поражений и сопутствующих заболеваний.
Острый подагрический артрит
Первоочередная цель медикаментозной терапии — уменьшение воспаления, интраартикулярной гипертензии и болевого синдрома. Следует избегать назначения гипоурикемических препаратов до купирования приступа в связи с их способностью пролонгировать острую атаку.
Препаратами первой линии при купировании острого подагрического артрита являются быстродействующие НПВП, применяемые в допустимо высоких терапевтических дозировках. При выборе препарата следует учитывать наличие у пациента риска побочных эффектов (желудочно-кишечных, кардиоваскулярных, почечных и др.). Чаще назначаются ибупрофен по 800 мг 3–4 раза в сутки, диклофенак по 200 мг/сут, напроксен 500 мг 2 раза в сутки. При высоком риске желудочно-кишечных осложнений циклооксигеназу-2 (ЦОГ-2) неселективные препараты следует использовать в комбинации с ингибиторами протоновой помпы, а в качестве альтернативы применять ЦОГ-2 селективные НПВП (целекоксиб по 200–400 мг/сут). Используемый в течение десятилетий индометацин нежелательно применять у пожилых лиц из-за высокого риска со стороны желудочно-кишечного тракта, почек и центральной нервной системы.
С целью купирования острого подагрического артрита в течение многих лет успешно применяется колхицин. Лечение колхицином более успешно при назначении его в первые сутки и даже часы после развития подагрического приступа. Клинический эффект колхицина проявляется быстрее, чем НПВП, но в отличие от последних ассоциируется с более высокой частотой побочных эффектов. В связи с этим сегодня рекомендуется осторожность при применении колхицина: 0,5 мг препарата каждый час до наступления эффекта, или развития побочных реакций (рвота, диарея, понос), или достижения максимальной дозы (не более 6 мг за 12 ч). Жизнеугрожающая интоксикация колхицином может отмечаться у пациентов с ПН даже при применении более низких доз. В связи с этим применять колхицин следует после определения уровней креатинина и скорости клубочковой фильтрации.
При внутривенном применении колхицина наблюдается высокая токсичность, что делает неприемлемым такой путь введения препарата. Комбинированная терапия НПВП с колхицином не имеет преимуществ над их раздельным использованием. Неэффективность НПВП, противопоказания к их применению или непереносимость служат основанием для использования колхицина.
При острых приступах подагры, резистентных к НПВП или колхицину, показано применение глюкокортикоидов (Гк), позволяющее достигнуть хорошего клинического эффекта. В зависимости от клинических особенностей острой подагрической атаки используются различные пути применения Гк. При единичных поражениях крупных или мелких суставов хороший эффект достигается при интраартикулярном введении Гк (триамцинолон 40 мг или метилпреднизолон 40–80 мг и 5–20 мг триамцинолона или 20–40 мг метилпреднизолона соответственно). При полиартикулярной атаке подагры Гк применяются внутримышечно или внутривенно. При этом используется несколько внутримышечных или внутривенных введений метилпреднизолона (по 40 и 125 мг соответственно). Для перорального применения используются преднизолон или метилпреднизолон в минимальных или умеренных дозировках в течение нескольких дней.
Сообщается о повышении клинического эффекта при комбинации Гк с колхицином.
В патогенезе подагры важное место отводится ИЛ-1β, в связи с чем изучается возможность использования антагонистов ИЛ-1 в лечении острой подагрической атаки (канакинумаб — анти-ИЛ-1 моноклональные антитела) и др. Эффективность и безопасность такого подхода требует дальнейшего изучения в КРИ.
Хроническая тофусная подагра
Лечебная стратегия при хронической тофусной подагре предполагает комбинацию немедикаментозных подходов с медикаментозной терапией.
Немедикаментозные подходы и диетический режим при хронической тофусной подагре аналогичны таковым при остром подагрическом артрите, что описано выше.
Показания для гипоурикемической лекарственной терапии:
— рецидивы суставных подагрических атак;
— наличие тофусов;
— поражение суставов и хрящей;
— сопутствующее поражение почек, уратный нефролитиаз;
— повышение уровней мочевой кислоты сыворотки крови.
Для снижения уровня мочевой кислоты сыворотки крови используются три группы препаратов:
— ингибиторы ксантиноксидазы (аллопуринол, фебуксостат);
— урикозурические агенты (пробенецид, сульфилпиразон, бензбромарон);
— урикозные препараты.
Ингибиторы ксантиноксидазы (аллопуринол, фебуксостат)
Из урикодепрессивных средств, т.е. угнетающих синтез мочевой кислоты, в течение десятилетий применяется аллопуринол, являющийся структурным аналогом гипоксантина, препятствущим образованию мочевой кислоты за счет ингибиции ксантиноксидазы — фермента, превращающего гипоксантин в ксантин и мочевую кислоту. В меньшей степени аллопуринол угнетает активность гипоксантин-гуанин-фосфорибозилтрансферазы. Препарат обладает антиоксидантным и мягким иммунодепрессивным действием (за счет накопления в иммунокомпетентных клетках аденозина).
Действие аллопуринола начинается на вторые сутки после начала его применения. Период полувыведения достигает 22 ч, что позволяет суточную дозу препарата принимать однократно утром. Начальная доза препарата зависит от концентрации мочевой кислоты в крови, возраста, функции почек и обычно составляет 50–300 мг/сут, но не должна превышать 900 мг. Не рекомендуется применять аллопуринол в сочетании с препаратами железа и пероральными антикоагулянтами. Лечение проводят длительно (неопределенно долго). Больным с концентрацией мочевой кислоты в крови менее 450 мкмоль/л аллопуринол назначают в начальной дозе около 150 мг/сут или по 300 мг через день. При повышении уровня креатинина крови до 0,2 ммоль/л и оксипуринола до 130 мкмоль/л дозу препарата следует уменьшить вдвое, а у больных с уровнем креатинина более 0,4 ммоль/л и оксипуринолемии свыше 230 мкмоль/л аллопуринол противопоказан.
Побочные эффекты аллопуринола чаще обусловлены механизмами гиперчувствительности замедленного типа и характеризуются лихорадкой, лейкоцитозом, ускорением СОЭ, кожными высыпаниями (от макулопапулезной сыпи до эксфолиативного дерматита).
У части больных при лечении аллопуринолом развиваются тошнота, диарея, повышение уровней печеночных трансаминаз.
В остром периоде аллопуринол не показан. Целесообразно его назначение после прекращения клинических проявлений острого артрита и продолжать прием в подобранной дозе в межприступном периоде для профилактики обострений подагры неопределенно долго.
Недавно опубликованы результаты нескольких исследований, в которых показано, что сывороточные уровни мочевой кислоты являются независимым фактором риска развития и прогрессирования ПН у больных с диабетической и недиабетической нефропатией, а применение аллопуринола, снижающего или нормализующего гиперурикемию, ассоциировалось с замедлением прогрессирования ПН.
Кроме того, продемонстрирована способность аллопуринола (средняя доза 300 мг/сут) вызывать регрессию массы левого желудочка за счет снижения постнагрузки, а также улучшение функции эндотелия у больных с хроническим поражением (заболеванием) почек (3-я стадия) и наличием гипертрофии левого желудочка. При длительном наблюдении (9 месяцев) не было отмечено снижения функции почек ни у одного из больных.
Фебуксостат (febuxostat) — новый селективный ингибитор ксантиноксидазы (в Украине не зарегистрирован). Согласно данным двух КРИ, он позволяет достигать более значительного снижения уровня уратов в крови по сравнению с аллопуринолом у пожилых людей с подагрой или гиперурикемией. Фебуксостат не выводится почками, в связи с чем его можно применять у пациентов с тяжелой ПН. В этом кардинальное отличие фебуксостата от аллопуринола. Среди побочных эффектов фебуксостата выделяют артралгии, миалгии, диарею. Требует уточнения наличие неблагоприятных эффектов препарата на сердечно-сосудистую систему.
Урикозурические препараты уменьшают реабсорбцию и увеличивают секрецию мочевой кислоты в почечных канальцах. Механизм действия урикозуриков обусловливает ограничение их использования при нефролитиазном типе подагрической нефропатии и полный отказ от них при ПН. Обычно препараты назначают при суточной урикурии менее 700 мг. Среди них чаще используются бензбромарон (хипурик, дезурик, минурик) и близкий ему по составу бензйодарон (ампливикс, уриковак), обладающие определенным урикодепрессивным действием. Переносимость препаратов обычно хорошая. У части больных наблюдаются побочные эффекты в виде боли в поясничной области, позвоночнике и животе, диареи, головокружения, крапивницы.
Широкое распространение получили также пробенецид (бенемид, лонгацид, урелим) и этамид, хотя эффективность этих средств уступает бензбромарону и бензйодарону. В кислой среде почечных канальцев эти препараты реабсорбируются, а в щелочной — активно секретируются. Начальная доза пробенецида составляет 500–1000 мг/сут; спустя 2 недели ее увеличивают до 1500–3000 мг/сут. Этамид применяется по 2800 мг/сут курсами по 10 дней 1 раз в месяц. Из побочных эффектов следует отметить головную боль, головокружения, тошноту, дерматиты, повышение температуры, анемию. Пробенецид и этамид усиливают эффекты антикоагулянтов.
В лечении подагры возможно применение комбинации аллопуринола с урикозурическими средствами. Такой подход приемлем у больных с резистентностью к монотерапии.
При назначении аллопуринола и/или урикозурических препаратов необходимо контролировать рН мочи и ощелачивать ее с помощью применения цитратов с целью снижения риска образования камней и развития уратной нефропатии.
В качестве урикоразрушающих препаратов используются ферменты уратоксидаза (урикозим), гепатокаталаза (капераза) и уриказа. Уратоксидаза окисляет мочевую кислоту с образованием аллантоина, аллоксановой кислоты и мочевины. Ее назначают по 1000–3000 ЕД/сут на протяжении двух недель. Препарат не противопоказан при мочекаменной болезни. Из побочных действий иногда развивается крапивница. Гепатокаталаза повышает не только распад мочевой кислоты путем окисления, но и синтез ее в организме. Вводят этот фермент по 10 000–20 000 ЕД 2–3 раза в неделю на протяжении одного месяца. Курсы лечения повторяют ежеквартально. Переносимость гепатокаталазы хорошая. Уриказа в связи с высокой токсичностью сейчас для лечения подагры практически не используется. В свете доказательной медицины широкое применение данных ферментов в клинической практике требует проведения КРИ.
Урикозные агенты
Урикоза — фермент, обеспечивающий метаболизм мочевой кислоты в растворимую форму аллантоина. Препарат krystexxa (модифицированная рекомбинантная урикоза, в Украине не зарегистрирован) — это фермент, который понижает уровень мочевой кислоты, метаболизируя ее в метаболиты, легко выводящиеся из организма с мочой. Препарат применяется внутривенно в дозе 8 мг каждые 2 недели (с предварительной антигистаминной или Гк-премедикацией) с целью профилактики острых атак подагры и аллергических реакций. Применяется у больных с хронической подагрой для снижения сывороточных уровней мочевой кислоты, профилактики развития тофусов или снижения их размеров.
Применение krystexxa часто сопровождается развитием аллергических реакций. Другие побочные эффекты: тошнота, рвота, боль в грудной клетке и гематомы в месте инфузии.
Другие лечебные подходы
При уролитиазном типе нефропатии в комплексе с аллопуринолом назначают магурлит, блемарен, солуран и др. Эти препараты рассчитаны на сдвиг рН мочи в сторону щелочной реакции под влиянием цитратных ионов, а также на торможение образования и интенсификацию растворения конкрементов, состоящих из оксалата кальция (под действием ионов магния и пиридоксина). Из-за большого количества натрия и необходимости приема избыточных объемов жидкости (до 2 л/сут) цитратные смеси не показаны пациентам с плохо корригируемой АГ и СН.
АГ значительно ухудшает течение подагры и, в частности, подагрической нефропатии. Антигипертензивными препаратами первого ряда при подагре следует рассматривать антагонисты рецепторов ангиотензина ІІ, поскольку они обладают урикозурическим эффектом, который сопровождается усилением экскреции оксипуринола. Препараты этого класса повышают выведение уратов за счет уменьшения их реабсорбции в проксимальных канальцах почек. Урикозурический эффект сохраняется и при их комбинации с мочегонными средствами, благодаря чему предупреждается вызываемое диуретиками повышение уровня мочевой кислоты в крови. Гипоурикемический эффект оказывают также антагонисты кальция.
В 2006 г. экспертами-ревматологами EULAR были разработаны рекомендации по ведению больных подагрой, базирующиеся на результатах многочисленных КРИ, посвященных оценке эффективности различных лечебных подходов при подагре.
Рекомендации EULAR (2006) по ведению больных с подагрой
1. Оптимальное лечение подагры должно включать немедикаментозные и медикаментозные подходы и базироваться в соответствии:
— со специфическими факторами риска (уровень мочевой кислоты в крови, предшествующие атаки заболевания, рентгенологические изменения);
— клинической фазой (острая/возвратная подагра, подострая подагра, хроническая тофусная подагра);
— общими факторами риска (возраст, пол, ожирение, алкоголизм, функция почек, прием препаратов, повышающих уровень уратов сыворотки, лекарственное взаимодействие, коморбидность).
2. Изменение стиля жизни (обучение больного): снижение массы тела при ожирении, диетический режим, уменьшение потребления алкоголя (особенно пива), что является одним из ведущих факторов эффективности терапии.
3. Адекватная терапия коморбидных заболеваний (патологических состояний), устранение или оптимальный контроль факторов риска (гиперлипидемия, АГ, СН, ПН, гипергликемия, ожирение и курение) должны рассматриваться как важный компонент в ведении больных подагрой.
4. Пероральные колхицин и/или НПВП — агенты первой линии при острой подагре. При отсутствии противопоказаний НПВП являются достаточно приемлемым выбором.
5. Высокие дозы колхицина (первоначально 1 мг, а затем по 0,5 мг через каждые 2 ч) сопряжены с побочными эффектами (тошнота, рвота, диарея). В то же время низкие дозы (например 0,5 мг 3 раза в сутки) могут оказывать достаточный эффект у части больных.
6. Интраартикулярная аспирация и инъекция Гк продленного действия эффективны и безопасны при острой атаке заболевания, что особенно приемлемо при тяжелой моноартикулярной атаке, а также больным, где противопоказаны колхицин и НПВП. В тяжелых случаях, где противопоказаны колхицин и НПВП и/или невозможно внутрисуставное введение Гк, приемлемо и эффективно назначение системных Гк.
7. Терапия, снижающая уровень мочевой кислоты в крови, показана больным с повторными острыми атаками, артропатией, тофусами или рентгенологическими изменениями, множественным поражением суставов или уратным нефролитиазом.
8. Цель терапии, снижающей уровень уратов, — способствовать растворению кристаллов и превентировать их формирование. Это достигается путем мониторирования сывороточных уровней мочевой кислоты ниже точки насыщения для мононатриевых уратов (≤ 360 мкмоль/л). Целью уратоснижающей терапии является превентирование формирования уратных кристаллов и увеличения растворения кристаллов. Следует поддерживать уровень мочевой кислоты сыворотки ниже 360 мколь/л, что ниже точки насыщения мононатриевых уратов.
9. Аллопуринол является приемлемым препаратом для длительной терапии, снижающей содержание сывороточных уратов. Его применение следует начинать с низких дозировок (100 мг/сут) и увеличивать на 100 мг каждые 2–4 недели (обычно до 300 мг/сут), если это необходимо. Доза препарата должна корригироваться с состоянием почечной функции. Если лечение аллопуринолом сопровождается развитием токсических эффектов, то терапия может осуществляться урикозурическими препаратами (пробенецид или сульфинпиразон).
10. Такие урикозурические агенты, как пробенецид и сульфинпиразон, могут использоваться в качестве альтернативы аллопуринолу у больных с нормальной функцией почек, но относительно противопоказаны больным с уролитиазом. Бензбромарон может применяться у больных с легкой и умеренной почечной недостаточностью, но ассоциируется с риском развития гепатотоксичности.
11. Профилактика рецидивов обострения подагры после первой атаки может быть достигнута применением колхицина (0,5–1,0 г/сут) и/или НПВП (с проведением гастродуоденальной протекции, если это необходимо).
12. При ассоциации развития подагры с диуретической терапией, если это возможно, ее следует прекратить. При АГ и гиперлипидемии следует рассмотреть применение лосартана и фенофибрата соответственно (оба препарата обладают умеренным урикозурическим эффектом).
Прогноз
Прогноз при подагре относительно благоприятный, особенно при проведении адекватной терапии. В 20–50 % случаев развивается нефролитиаз, осложняющийся вторичным пиелонефритом и развитием ПН, являющейся ведущей причиной летальных исходов; развитие ПН также может быть обусловлено подагрической нефропатией.
Примеры формулировки диагнозов
Острый подагрический артрит, І атака с поражением первого пальца стопы, рентген-стадия 0, СФН ІІІ.
Хронический подагрический артрит, полиартрит, обострение с поражением суставов стопы, коленных суставов с наличием периферических тофусов в области ушных раковин, рентген-стадия ІІ, СФН ІІ, уролитиаз.
- Мороз Г.З. Діагностика, лікування та профілактика подагри в роботі сімейного лікаря // Журнал практичного лікаря. — 2007. — № 5–6. — С. 35-40.
- Ревматология / Национальное руководство под редакцией Е.Л. Насонова, В.А. Насоновой. — М.: ГЕОТАР-Медиа, 2008. — 720 с.
- Свінціцький А.С., Яременко О.Б., Пузанова О.Г., Хомченкова Н.І. Ревматичні хвороби та синдроми. — К.: Книга-плюс, 2006. — 680 с.
- Синяченко О.В., Баринов Э.Ф. Подагра. — Донецк: изд-во Донецкого медицинского университета, 1994. — 247 с.
- Коваленко В.Н., Шуба Н.М. Ревматические болезни: номенклатура, классификация, стандарты диагностики и лечения. — К.: ООО «Катран груп», 2004. — 212 с.
- Annemans L., Spaepen E. et al. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005 // Ann. Reum. Dis. — 2008. — 67. — Р. 960-966.
- Dalbeth N., So A. Hyperuricaemia and gout: state of the art and future perspectives // Ann. Rheum. Dis. — 2010. — 69(10). — Р. 1738-1743.
- Doria A., Krolewski A. Lowering serum uric acid levels to prevent kidney failure // Nature Rev. Nephrology. — 2011. — 7. — Р. 495-496.
- Harrold I.R., Yood R.A. et al. Sex differences in gout epidemiology: evaluation and treatment // Ann. Rheum. Dis. — 2006. — 65(10). — Р. 1368-1372.
- Kao M. et al. Allopurinol benefits left ventricular mass and endothelial dysfunction in chronic renal disease // J. Am. Soc. Nephrol. — 2011. — 22. — Р. 1382-1389.
- Pascual E., Perdiguero M. Gout, diuretics and the kidney // Ann. Reum. Dis. — 2006. — 65(8). — Р. 981-982.
- Pascual E., Sivera F. Why is gout so poorly managed? // Ann. Rheum. Dis. — 2007. — 66. — Р. 1269-1270.
- Roddy E., Zhang W. et al. Concordance of the management of chronic gout in a UK primary-care population with the EULAR gout recommendations // Ann. Reum. Dis. — 2007. — 66. — Р. 1311-1315.
- Schumacher H.R., Becker M.A. et al. Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study // Rheumatology. — 2009. — 48. — Р. 188-194.
- Sutaria S., Katbamna R., Underwood M. Effectiveness of interventions for the treatment of acute and prevention of recurrent gout — a systematic review // Rheumatology. — 2006. — 45(11). — Р. 1422-1431.
- Zhang W., Doherty et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT) // Ann. Rheum. Dis. — 2006. — 65. — Р. 1301-1311.
- Zhang W., Doherty et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee For International Clinical Studies Including Therapeutics (ESCISIT) // Ann. Rheum. Dis. — 2006. — 65. — Р. 1312-1324.


