Журнал «Медицина неотложных состояний» 7-8 (46-47) 2012
Вернуться к номеру
Острая почечная недостаточность
Авторы: Думанский Ю.В., Кабанова Н.В., Верхулецкий И.Е., Синепупов Н.А., Осипов А.Г., Синепупов Д.Н. - ДонНМУ им. М. ГорькогоУ им. М. Горького
Рубрики: Медицина неотложных состояний
Разделы: Медицинское образование
Версия для печати
Актуальность
Острая почечная недостаточность (ОПН) — это резкое внезапное нарушение всех внутрипочечных функций: гемо- и гидродинамики, клубочковой фильтрации, канальцевой секреции и реабсорбции. В результате нарушается гомеостаз, что проявляется гиперазотемией, глубокими нарушениями водно-электролитного обмена, кислотно-основного состояния, артериальной гипертензией, анемией. ОПН развивается у 5 % госпитализированных пациентов; их доля в отделении интенсивной терапии равна 10–23 %. Половина причин госпитальной ОПН — ятрогенные, обусловленные обширными хирургическими вмешательствами (например, ОПН развивается у 2–7 % пациентов после операций на открытом сердце). Развитие ОПН увеличивает летальность в 6–8 раз. При изолированной ОПН летальность составляет 15–20 %. Если ОПН входит в состав полиорганной недостаточности, то летальность достигает 85–95 %. Летальность у пациентов с олигурией составляет 50 %, без олигурии — 26 %. Прогноз обусловлен как тяжестью основного заболевания, так и клинической ситуацией. Например, при остром канальцевом некрозе (ОКН), обусловленном хирургическим вмешательством или травмой, летальность составляет 60 %, в случае развития ОКН в качестве осложнения лекарственной болезни — 30 %, при беременности — 10–15 %. Смерть при ОПН чаще всего наступает от уремической комы, нарушений гемодинамики сепсиса. Важнейшим условием успешного лечения пациентов с ОПН является ранняя ее диагностика. Более чем у половины пациентов причиной ОПН являются множественная травма, водно-электролитные и гемодинамические нарушения, нетравматический рабдомиолиз, а нарушения почечной гемодинамики и экзогенные интоксикации сопровождаются ОПН у 90 % пациентов.
Прогресс реанимации, улучшение оснащения реанимационных отделений, внедрение в клиническую практику все более эффективных антибактериальных препаратов, новых подходов к гемодинамической, реокорригирующей, антиоксидантной терапии и респираторной поддержки привели к увеличению пациентов, переживших ОПН.
В связи с этим перспективы временного замещения утраченных почечных функций весьма заманчивы. Начавшись с примитивных способов удаления экзо- и эндотоксинов из организма (кровопускание, применение слабительных и мочегонных средств), эфферентная медицина становится наиболее эффективным методом в рамках комплексного лечения синдрома экзо- и эндогенной интоксикации. Вместе с тем возможности временной поддержки и даже замещения естественных систем адаптации и компенсации нарушенных почечных функций значительно расширяются с ростом числа новых и все более эффективных методов экстракорпоральной детоксикации, направленных на изменение клеточного, белкового, электролитного, газового состава крови путем ее внеорганизменной обработки.
Цель занятия общая: диагностировать синдром острой почечной недостаточности и проводить интенсивную терапию пациентам с острой почечной недостаточностью.
Содержание обучения
I. Теоретические вопросы
1. Анатомия и физиология мочевыделительной системы.
2. ОПН, формы ОПН, патофизиология, клиническое течение, физиологические и биохимические нарушения. Методы диагностики.
3. Алгоритмы интенсивной терапии на разных стадиях ОПН. Методы внепочечного очищения (гемодиализ, гемофильтрация, ультрафильтрация, перитонеальный диализ).
II. Основные термины и их определения
Острая почечная недостаточность (ОПН) — быстрое и резкое снижение функции почек, связанное чаще всего с их ишемией, токсическим или иммунным поражением, протекающее с дисфункцией канальцев, уменьшением осмолярности мочи, нарастанием содержания в сыворотке крови креатина, остаточного азота (мочевины) и калия, развитием уремии. Выделяют следующие патогенетические формы ОПН:
1) преренальные (50–75 % от всех ОПН), обусловленные всеми видами шока, уменьшением объема циркулирующей крови (ОЦК) (кровотечения, потеря воды и электролитов при обильной рвоте, поносе, ожогах, быстром накоплении асцита) либо ухудшением микроциркуляции в почках вследствие вазоконстрикции, гемолиза и внутрисосудистого свертывания крови (септический, гиповолемический, травматический шок, посттрансфузионные осложнения, гемолитико-уремический синдром, тромботическая тромбоцитопеническая пурпура Мошковица); 2) почечные (ренальные), связанные с острым гломерулонефритом и острым интерстициальным нефритом, миоглобинурией (синдромы компрессии и раздавливания, турникетный шок), а также с нефротоксическим действием ряда веществ: солей тяжелых металлов, рентгеноконтрастных препаратов, некоторых антибиотиков (неомицин, рифампицин) и анестетиков (метоксифлуран, фторотан), сульфаниламидов; 3) постренальные, связанные с закупоркой мочевыводящих путей уратами, оксалатами, белковыми коагулятами, сгустками крови. При многих формах взаимодействуют разные патогенетические механизмы, ведущие к развитию ОПН (гиповолемия, шок, инфекция с вазоконстрикцией, токсическое действие лекарственных препаратов).
Различают следующие фазы ОПН: 1) начальную, или пусковую, при которой доминируют признаки патологического процесса, вызвавшего ОПН (шок, инфекционные осложнения, сепсис, гемолиз, обильная потеря жидкости и электролитов, а также признаки диссеминированного внутрисосудистого свертывания крови; 2) фазу олигоанурии — резкое снижение диуреза (вплоть до почти полного отсутствия мочи), нарушение концентрационной и азотовыделительной функции почек, развитие симптомов уремии; 3) фазу ранней полиурии — быстрого нарастания диуреза при сохраняющейся низкой относительной плотности мочи (наступает при успешном выведении больного из второй фазы); 4) фазу восстановления функции почек и нарастания удельной плотности мочи до 1,017–1,020.
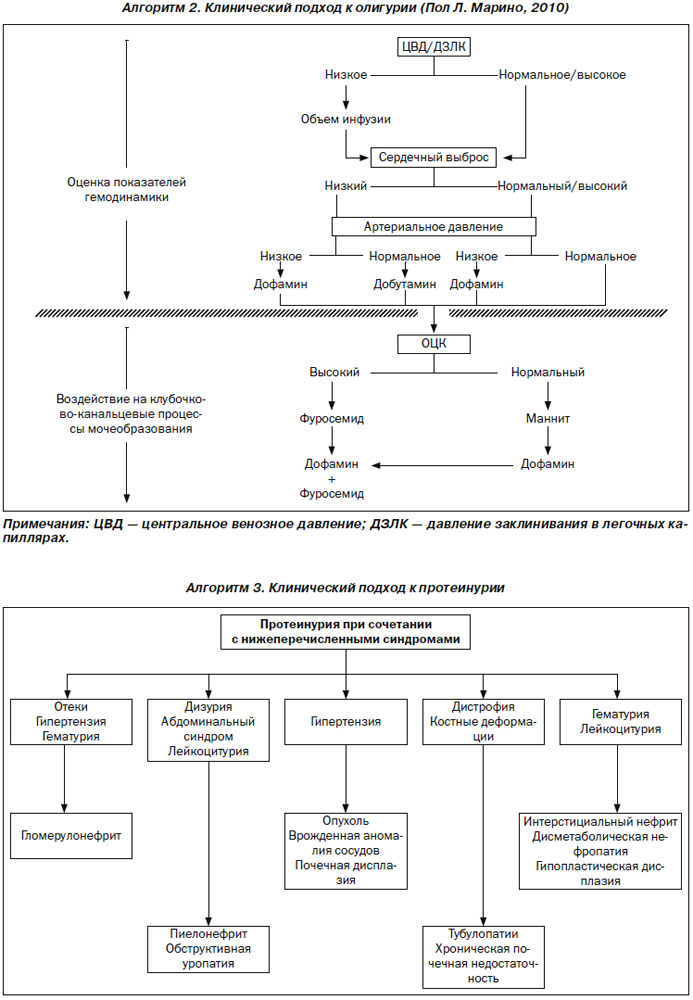
Олигурия (диурез менее 500 мл/сут) — грозный признак, летальность при ОПН с олигурией достигает 90 %. Необходим контроль за олигурией (для того, чтобы оценить ее характер и значение для организма). При первых симптомах олигурии или анурии необходимо убедиться в нормальном функционировании катетера, введенного в мочевой пузырь. Это особенно важно при выделении мочи менее 50 мл/сут (анурия). Патогенетически (с учетом анатомо-функциональных факторов) традиционно различают 3 типа олигурии: преренальную, ренальную и постренальную. Основная причина, приводящая к преренальной олигурии, состоит в снижении почечного кровотока, что может быть результатом слабого сердечного выброса либо неадекватного кровообращения в почках (гипоперфузия). Олигурия этого типа возникает на фоне общих клинических расстройств — гиповолемии, вазодилатации, острой сердечной недостаточности. Ренальная олигурия характеризуется паренхиматозной почечной недостаточностью и может возникнуть вследствие поражения паренхимы почки различными повреждающими факторами. Однако в большинстве случаев ОПН с олигурией вызывают два заболевания: острый некроз канальцев и острый интерстициальный нефрит. Острый гломерулонефрит нечасто встречается у больных, находящихся в отделениях интенсивной терапии. Острый некроз канальцев (ОНК) вызывается самыми разнообразными причинами, в том числе ишемией, сепсисом, хирургическими вмешательствами, лекарственными средствами, ядами растительного и животного происхождения, пигментами (например, миоглобином). Острый интерстициальный нефрит (ОИН) обусловлен реакцией гиперчувствительности, развивающейся в почках вследствие воздействия лекарственных средств (известно по меньшей мере 40 таких препаратов, причем наиболее часто ОИН вызывают пенициллины и нестероидные противовоспалительные средства (НПВС)). Клинические проявления ОНК и ОИН похожи. Несмотря на то что ОИН сопровождается лихорадкой, кожными высыпаниями и суставными болями, в 40 % случаев высыпания могут быстро исчезать, а лихорадка отсутствовать. ОПН с олигурией у пациентов, находящихся в отделениях интенсивной терапии, обычно указывает на системные поражения организма (сепсис, полиорганная недостаточность, токсическое действие лекарственных средств, красителей). Постренальная олигурия обусловлена нарушением оттока мочи из почек. К развитию постренальной олигурии может привести препятствие оттоку мочи как в собирательных трубочках и протоках, так и на любом уровне мочевыводящих путей (одностороннее либо двустороннее). Группа постренальных факторов включает в себя, в частности, обструкцию разной выраженности и локализации, например на уровне сосочковых протоков (некроз почечных сосочков), мочеточника (забрюшинные опухоли), внутреннего отверстия мочеиспускательного канала (стриктуры, конкремент, патология предстательной железы).
Снижение почечного кровотока сопровождается увеличением реабсорбции натрия и уменьшением его экскреции с мочой. Наоборот, при ОПН происходит снижение реабсорбции данного электролита и его выделение с мочой увеличивается. Следовательно, определяя концентрацию натрия в моче, можно простым способом отличить преренальный тип олигурии от ренального. Содержание натрия в моче менее 20 ммоль/л при олигурии обычно указывает на преренальную патологию.
Для характеристики выведения натрия почками используют ряд показателей, в том числе фракционную экскрецию натрия (ФЭNA), отражающую часть электролита, проходящую через клубочковый фильтр и экскретируемую с мочой. ФЭNA вычисляют, сравнивая почечный клиренс натрия с клиренсом креатинина. ФЭNA — один из наиболее информативных показателей, используемых для идентификации почечной недостаточности.

Если при олигурии значение ФЭNA ниже 1 %, то почечные канальцы функционируют вполне нормально, что опровергает диагноз ОНК. В настоящее время определение ФЭNA остается наилучшим лабораторным тестом, используемым в отделениях интенсивной терапии для дифференциации преренальной олигурии с ОПН.
Микроскопическое исследование осадка мочи следует проводить при любом подозрении на острую почечную недостаточность.
1. В случае наличия преренальных факторов осадок мочи содержит неспецифические элементы — гиалиновые или зернистые цилиндры.
2. При ОНК осадок мочи изобилует эпителиальными клетками и эпителиальными цилиндрами вместе с грубыми зернистыми цилиндрами.
3. При ОИН осадок мочи может содержать лейкоциты и лейкоцитарные цилиндры. Эритроциты и эритроцитарные цилиндры характерны для острого гломерулонефрита, но могут встречаться и при других патологических процессах, приводящих к острой почечной недостаточности.
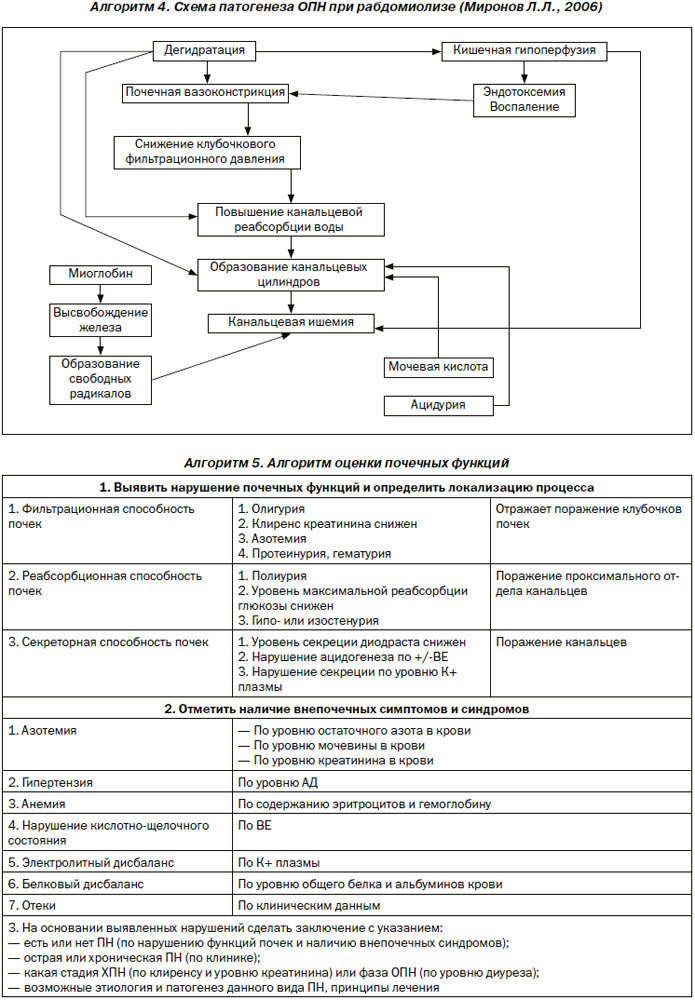
Рабдомиолиз — острый некроз скелетных мышц, сопровождающийся ОПН. Одним из признаков возможного некроза скелетной мускулатуры считается ежедневное возрастание содержания креатинина и значений других биохимических показателей в сыворотке крови. За сутки уровень креатинина повышается не более чем на 10 мг/л, а мочевина крови — на 300 мг/л. Хорошим диагностическим тестом является определение активности креатинфосфокиназы в сыворотке крови, поскольку нормальная активность фермента позволяет полностью исключить рабдомиолиз. В случае тяжелого рабдомиолиза в кровь выделяется большое количество миоглобина и креатинина, что вызывает повышение активности ряда кишечных ферментов, в том числе креатинфосфокиназы. Установить источник их происхождения (сердечная мышца или скелетная мускулатура) можно, определяя активность альдолазы сыворотки крови. Как известно, альдолаза — фермент, локализованный в поперечнополосатых мышцах; повышенная активность альдолазы позволяет считать ее источником скелетные мышцы (у людей имеется 3 типа альдолаз (групповое название ферментов, участвующих в механизме анаэробного расщепления углеводов): мышечный, печеночный и мозговой; мы подразумеваем альдолазы мышечного типа). Немедленно после установления диагноза следует начать интенсивную инфузионную терапию.
Большинство пациентов поступают в отделение реанимации в состоянии общего избытка воды и натрия в организме. У пациентов с нормальной функцией почек диурез должен поддерживаться на уровне не менее 1 мл/кг/ч. Серьезными последствиями олигурии являются отек легких и мозга, гиперволемия (перегрузка объемом), гиперкалиемия, ацидоз, токсичность лекарственных препаратов. Целью интенсивной терапии ОПН является профилактика этих потенциально летальных осложнений и ишемии почек:
1. Оптимизация гемодинамики, поддержка АДср на уровне 80–100 мм рт.ст. Контроль за функцией почек у пациентов в критическом состоянии должен обязательно включать оценку как количественных характеристик диуреза, так и качественного состава мочи.
2. Активное лечение гипоксии.
3. Обеспечение нулевого или даже отрицательного баланса (до –500 мл/сут) для профилактики отека легких при анурии.
4. Мониторинг электролитного состава крови, кислотно-основного равновесия (КОР). Недопустимо добавление калия к инфузионным растворам и применения лекарств, которые могут повысить уровень калия (ингибиторы ангиотензинпревращающего фермента (иАПФ)). Лечение ацидоза.
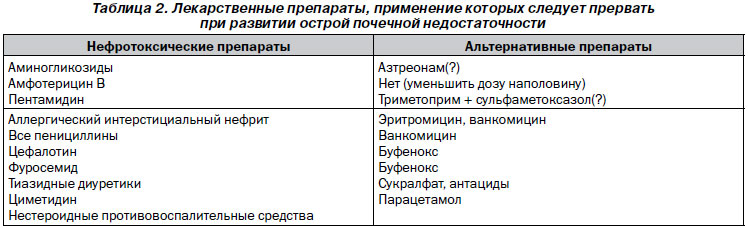
5. Недопустимость применения нефротоксичных препаратов (аминогликозидов, НПВС, иАПФ), контроль доз препаратов, зависящих от почечного выведения (дигоксин, антибиотики: ванкомицин и амикацин).
6. В комплекс интенсивной нефропротекции включают осмодиуретики (маннитол, 10–20–40% раствор глюкозы, 7,5–10% раствор хлорида натрия), дилататоры приносящей артериолы (дофамин в дозах 1–2 мкг/кг/мин, эуфиллин 8–10 мг/кг в сутки), а затем петлевые диуретики (фуросемид), применение которых должно осуществляться в виде болюса 3 мг/кг с последующей дозированной инфузией со скоростью 0,5 мг/кг/ч. Отсутствие выраженного диуретического эффекта от проводимой терапии, снижение скорости клубочковой фильтрации, а также рост креатинина или мочевины в течение суток более чем в 1,5 раза являются показанием для проведения заместительной почечной терапии. Раннее начало экстракорпоральной детоксикации позволяет предотвратить развитие полиорганной недостаточности.
7. Пациентам, которые могут принимать пищу, рекомендуется прием диеты, богатой эссенциальными аминокислотами. Пациентам на гемодиализе требуется повышенное содержание белка в пище (1,5 мг/кг/день), поскольку диализ характеризуется отрицательным азотистым балансом.
8. По показаниям выполняется УЗИ почек, ангиография почечных артерий.
Заместительная почечная терапия (ЗПТ) — это комплекс разнородных по своей структуре и основополагающим принципам процедур, проводимых для поддержания жизни пациента с утраченными функциями собственных почек. К методам ЗПТ относят программный гемодиализ, перитонеальный диализ (ПД) и трансплантацию почки. Для того чтобы понять эффективность каждого из этих методов, необходимо рассмотреть функции здоровой почки и возможность замены каждым из имеющихся методов заместительной почечной терапии. Так, здоровая почка регулирует содержание воды в организме, удаляет шлаки, регулирует баланс электролитов и КОР крови. Каждая их этих функций может быть частично заменена применением диализных методов. Кроме этого, почка выделяет гормоны, стимулирующие кроветворение, активизирует витамин D и регулирует кровяное давление: эти функции могут быть заменены частично или полностью применением дополнительной медикаментозной терапии, а такая функция, как инактивация излишних гормонов, может быть обеспечена только нормально функционирующей почкой. Показаниями к ЗПТ являются гиперкалиемия, ацидоз, отек легких, токсичность лекарственных препаратов, прогрессирующая уремия, или перикардит, энцефалопатия, судороги, коагулопатия в результате уремии. При отсутствии эффекта от консервативной терапии, вероятно, нецелесообразно ожидать развития перечисленных осложнений ОПН. Следует рассмотреть оправданность раннего начала заместительной почечной терапии.
Гемодиализ и гемофильтрация
Существует две основные методики заместительной почечной терапии, которые применяют в отделении интенсивной терапии и реанимации: гемодиализ и гемофильтрация. В обоих случаях кровь из кровеносного русла пациента проходит по экстракорпоральному контуру, который включает диализатор и/или гемофильтр.
1. При гемодиализе кровь проходит с одной стороны полупроницаемой мембраны, а с другой стороны в противоположном направлении течет кристаллоидный раствор.
2. При гемофильтрации кровь под давлением протекает с одной стороны высокопроницаемой мембраны, с другой стороны которой находится неподвижный кристаллоидный раствор.
3. При гемодиализе удаление растворенных в крови веществ зависит от диффузии. Молекулы двигаются из раствора с большей концентрацией (т.е. из крови) в раствор с меньшей концентрацией (т.е. в диализирующий раствор). При этом маленькие молекулы двигаются быстрее, поэтому количество удаляемого вещества зависит от его концентрации в крови и диализирующем растворе и от размера молекулы.
4. При гемофильтрации удаление растворенных веществ с молекулярной массой до 20 000 дальтон зависит от конвекции, как при клубочковой фильтрации. При этом все молекулы удаляются с одинаковой скоростью, происходит удаление всех ионов.
5. При гемодиализе большие молекулы не всегда эффективно удаляются.
6. При гемофильтрации большие молекулы удаляются эффективнее, поэтому может понадобиться увеличение доз таких препаратов, как гепарин, инсулин и ванкомицин. Кроме того, происходит снижение концентрации медиаторов воспаления и пирогенов, что приводит к уменьшению пирексии и системного воспаления.
7. При гемодиализе происходит удаление контролируемого количества натрия и воды в результате создания трансмембранного градиента давления.
8. При гемофильтрации происходит удаление больших количеств воды и солей. Эти потери должны замещаться введением в дистальную часть колонки для гемофильтрации соответствующих количеств кристаллоидного раствора физиологического состава.
Гемофильтрация стала распространенной формой почечной заместительной терапии при острой почечной недостаточности, несмотря на то, что она в несколько раз дороже диализа. Это связано с непрерывностью процесса терапии, что соответствует тяжести состояния пациента с полиорганной недостаточностью. При длительном, непрерывном проведении заместительной терапии отмечается меньше осложнений, чем при традиционном гемодиализе. Существует несколько вариантов непрерывной почечной заместительной терапии:
— Постоянная артериовенозная гемофильтрация (САVН).
Это одна из первых и простых форм фильтрации. Для ее проведения устанавливаются катетеры в бедренную артерию и вену, и кровь проходит через колонку для гемофильтрации под действием только артериального давления. Поэтому этот метод фильтрации неприемлем для пациентов с малым сердечным выбросом. Длительная катетеризация бедренной артерии увеличивает риск ишемии конечности.
— Постоянный артериовенозный гемодиализ с фильтрацией.
Клиренс для CAVH составляет 10 мл/мин, поэтому в контур аппарата добавляется диализирующая колонка с соответствующим оборудованием, что позволяет увеличить клиренс.
— Постоянная веновенозная гемофильтрация (CVVH).
В контур аппарата включается дополнительный насос, создающий движение крови, поэтому достаточно только катетеризации венозного сосуда. Аппарат контролирует поток крови и скорость фильтрации. Может быть достигнут клиренс до 100 мл/мин. Это наиболее часто используемая система в отделениях интенсивной терапии.
— Постоянный веновенозный гемодиализ с фильтрацией (гемодиафильтрация) (CVVHDF).
Гемодиафильтрация — это метод очищения крови, в котором удачно сочетаются гемодиализ и гемофильтрация (диффузия с конвекцией). При гемодиафильтрации одновременно происходят два процесса:
1. Гемодиализ — диффузия веществ через полупроницаемую мембрану диализатора между кровью пациента и диализирующей жидкостью.
2. Гемофильтрация — конвективный транспорт воды и растворенных в ней веществ через полупроницаемую мембрану гемофильтра.
— Ведение пациента «на гемофильтрации».
В центральную вену устанавливается двухпросветный катетер большого диаметра (8 Fr). Поток крови устанавливается на уровне 120–150 мл/мин, а скорость гемофильтрации — например, на 25–40 мл/мин (1500–2400 мл/ч). Насос замещающей жидкости настраивается так, чтобы обеспечивался необходимый баланс жидкости, т.е. желаемая скорость забора жидкости, или ультрафильтрации.
Проводится системная гепаринизация (в контур аппарата), скорость инфузии гепарина варьирует от 300 до 2 000 Ед/ч. У пациентов с высоким риском развития кровотечений системная гепаринизация нежелательна. В этом случае возможна региональная антикоагуляция с помощью цитрата. Частично цитрат удаляется при гемофильтрации или диализе, а также метаболизируется печенью. При применении этого метода возникает необходимость тщательного контроля уровня цитрата, а также кальция (и его коррекции путем постоянной инфузии в центральную вену). Применение цитратной антикоагуляции ограничено при печеночной и полиорганной недостаточности.
В состав замещающей жидкости часто входит лактатион, применяют также безлактатные растворы. Замещают магний, кальций, фосфаты и бикарбонаты.
В последнее время все большее распространение приобретает применение другого вида ЗПТ — перитонеального диализа, который не предполагает применения дорогостоящей аппаратуры. Для проведения процедуры перитонеального диализа в брюшную полость должен быть установлен перитонеальный катетер, через который вводят специальные растворы. Эта процедура проводится ежедневно, обычно четыре раза в день. Существенным положительным аспектом ПД является практическое отсутствие противопоказаний для проведения этих видов ЗПТ.

- Чепкий Л.П., Новицька-Усенко Л.В., Ткаченко Р.О. Анестезiологiя та iнтенсивна терапiя: Пiдручник для ВМНЗ III–IV рiвня акредитацiї. — К.: Вища школа, 2003. — 399 с.
- Невiдкладна медична допомога / За ред. Ф.С. Глумчера, В.Ф. Москаленка. — К.: Медицина, 2006. — 632 с.
- Сумин С.А. Неотложные состояния. — М.: ООО «Медицинское информационное агентство», 2005. — 752 с.
- Ливанов Г.А., Михальчук М.А., Калмансон М.Л. Острая почечная недостаточность при критических состояниях. — СПб., 2005. — 320 с.
- Марино П.Л. Интенсивная терапия. — М.: ГЭОТАР-Медицина, 1999. — 639 с.
- Шейман Д.А. Патофизиология почек. — М.: Бином, 2007. — 206 с.