Газета «Новости медицины и фармации» Антимикробная терапия (448) 2013 (тематический номер)
Вернуться к номеру
Особенности рациональной антибиотикотерапии у детей
Авторы: Татьяна Тлустова
Рубрики: Педиатрия/Неонатология, Пульмонология, Антибиотикотерапия
Разделы: Медицинские форумы
Версия для печати
12–13 сентября 2012 года в рамках XIV Сидельниковских чтений (XIV Всеукраинская научно-практическая конференция «Актуальные вопросы педиатрии») состоялся научный симпозиум,
посвященный рациональной антибактериальной терапии в педиатрической практике.
С докладом на тему «Внебольничные пневмонии у часто и длительно болеющих детей: наши предпочтения в выборе антимикробной терапии» выступил заведующий кафедрой пропедевтической педиатрии Донецкого национального медицинского университета им. М. Горького, доктор медицинских наук, профессор Евгений Исаакович Юлиш. Профессор отметил особую актуальность данной темы, так как широкое и зачастую необоснованное использование антибиотиков привело к распространению антибиотикорезистентных форм микроорганизмов (множественнорезистентных штаммов), устойчивых к нескольким классам антибактериальных препаратов. При этом установлено, что существует прямая зависимость между потреблением антибиотика и появлением и распространением резистентных к нему микроорганизмов.
В настоящее время имеются многочисленные данные об участившейся резистентности клебсиелл, кишечной палочки и протея к цефалоспоринам III и IV поколений. Развитие резистентности обусловлено плазмидами, передающимися горизонтально, то есть не дочерним клеткам, а уже существующим взрослым особям в процессе конъюгации (аналог полового акта у одноклеточных организмов). Это особенно важно, так как данный процесс может осуществляться не только в пределах одного вида, но и в пределах рода и семейства. Так, например, кишечная палочка может передавать свои плазмиды клебсиеллам и наоборот.
Единственным выходом предупреждения антибиотикорезистентности на сегодняшний день является рациональное использование уже имеющихся в нашем арсенале антибиотиков, что позволит не только сдерживать рост резистентности к ним микроорганизмов, но и повышать эффективность лечения инфекционных заболеваний.
Назначение антибактериальной терапии и выбор препарата для лечения должны базироваться на знаниях о преобладающих, этиологически значимых бактериальных патогенах, их вирулентности и чувствительности к противомикробным средствам. К сожалению, сегодня антибиотики в большинстве случаев назначаются без соответствующих показаний и необоснованно часто. Особенно профессор подчеркнул, что их применение при вирусных инфекциях — урон здоровью ребенка.
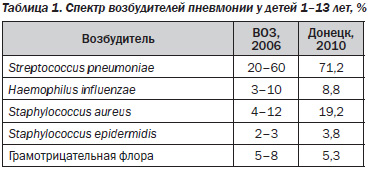
Пневмония является первой по значимости причиной смерти детей в мире — ежегодно она уносит жизни 1,8 млн детей в возрасте до пяти лет, более 98 % из которых проживают в 68 развивающихся странах. В табл. 1 представлены данные об этиологии внебольничной пневмонии у детей. Ведущее место в спектре возбудителей внебольничных пневмоний у детей как в мире, так и в Донецкой области занимает Streptococcus pneumoniae.
Среди антибиотиков, применяемых в настоящее время в клинической практике, одну из лидирующих позиций занимают цефалоспорины. Это связано со многими свойствами препаратов данной группы:
— широким бактерицидным спектром антимикробного действия;
— небольшой частотой резистентности микроорганизмов;
— устойчивостью к действию многих бета-лактамаз;
— хорошей переносимостью;
— небольшой частотой побочных эффектов;
— простотой и удобством дозирования.
Цефалоспорины І поколения обладают высокой активностью к грамположительным коккам и умеренной — к грамотрицательным аэробным бациллам (М.catarrhalis, E.сoli, K.pneumoniae, P.mirabilis). Устойчивы к ним и энтерококки.
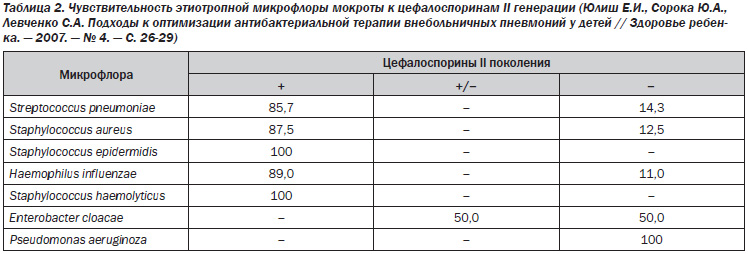
Цефалоспорины ІІ поколения по действию на грамположительную флору равноценны препаратам I поколения, но более активны в отношении грамотрицательных бактерий и некоторых штаммов энтеробактерий. Чувствительность цефалоспоринов ІІ поколения представлена в табл. 2.
Цефалоспорины III поколения характеризуются более широким спектром действия, чем І и ІІ. Препараты особенно активны в отношении грамотрицательных бактерий, в том числе синегнойной палочки, но по действию на стрептококки и стафилококки уступают таковым I–II поколений.
Цефалоспорины IV поколения обладают активностью в отношении бактероидов и других анаэробов.
Цефутил (цефуроксима аксетил) — цефалоспорин II генерации, обладающий высокой активностью к грамположительным возбудителям (стрептококки, стафилококки, включая PRSA), эффективен также в отношении грамотрицательных микробных агентов — Н.influenzae, М.catarrhalis, E.coli, P.mirabilis, включая b-лактамазообразующие штаммы, то есть флоры, преимущественно вызывающей внебольничные поражения органов дыхания. Высокоустойчив к бактериальным бета-лактамазам.
При оценке динамики клинических симптомов пневмонии на фоне терапии Цефутилом установлено, что регресс таких симптомов, как повышение температуры, одышка, интоксикация наблюдался к 3-му дню лечения. Ослабленного дыхания и укорочения перкуторного звука не отмечалось уже к 7-му дню лечения. Длительнее всего сохранялись кашель с отделением мокроты и локальные хрипы до 10 и 7 дней соответственно.
В случаях, когда энтеральный прием Цефутила был невозможным или труднодоступным (рвота, малый возраст), проводилась ступенчатая терапия: 1–2 дня цефалоспорин II генерации для парентерального использования — Цефумакс, затем переход на энтеральный антибиотик Цефутил.
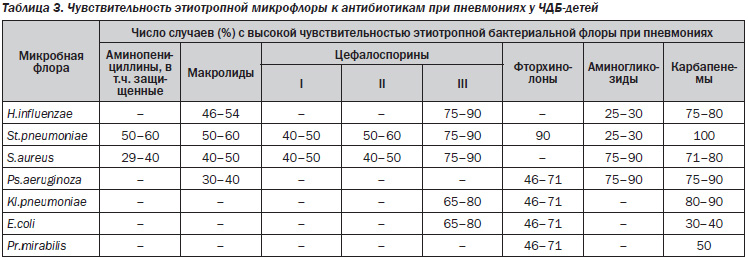
При наблюдении за часто и длительно болеющими детьми (ЧДБ; 350 человек) установлено, что к 4-летнему возрасту они получают 3,20 ± 0,17 курса антибиотиков. Средняя продолжительность заболевания неосложненными формами ОРЗ у ЧДБ детей в 3 раза превышает аналогичный показатель у других детей, бактериальные осложнения (синуситы, отиты) наблюдаются в 3,4 раза чаще, пневмонии — в 2,8, число госпитализаций — в 4,2 раза чаще. Чувствительность этиотропной микрофлоры к антибиотикам при пневмониях у ЧДБ-детей представлена в табл. 3.
В случаях тяжелого течения пневмоний, при рецидивирующих гнойных отитах, синуситах, у ЧДБ-детей, многократно получающих антибиотики, детей с сопутствующей патологией (онкогематологические заболевания, иммунодефициты), когда заболевание вызывается сочетанием грамположительной и грамотрицательной флоры, оптимален пероральный цефалоспорин III генерации Цефодокс (цефподоксима проксетил). Спектр действия данного препарата охватывает как грамположительную, так и грамотрицательную микрофлору. В отличие от некоторых других пероральных форм цефалоспоринов ІІІ поколения обладает выраженной активностью к пневмококкам, стрептококкам, гемофильной палочке, другим микроорганизмам, чаще всего вызывающим заболевания органов дыхательной системы.
Учитывая то, что одна из форм выпуска препарата — суспензия, Цефодокс может быть использован у детей с возраста пять месяцев. Особенности фармакокинетики препарата обеспечивают сохранение необходимой концентрации действующего вещества в плазме крови на протяжении 12 часов, что обусловливает возможность эрадикации возбудителей.
Отличительной особенностью препарата является его метаболизм в организме. Цефодокс — пролекарство, которое в желудочно-кишечном тракте превращается в свой активный метаболит — цефподоксим. Это свойство препарата обусловливает существенное снижение риска развития гастроинтестинальных осложнений, снижает риск развития антибиотикассоциированной диареи.
Еще одним аргументом в пользу применения в педиатрической практике Цефодокса является удобная форма выпуска препарата:
— суспензия 50 мл, содержащая в 5 мл 50 мг цефподоксима проксетила;
— суспензия 50 мл, содержащая в 5 мл 100 мг цефподоксима проксетила;
— таблетки, покрытые пленочной оболочкой, содержащие цефподоксима проксетила 100 мг;
— таблетки, покрытые пленочной оболочкой, содержащие цефподоксима проксетила 200 мг.
Профессор доложил о клиническом исследовании, проведенном на базе клиники. Целью работы являлось изучение клинической эффективности применения орального цефалоспорина III генерации Цефодокса как стартового антибиотика при лечении внебольничных пневмоний у детей.
Под наблюдением находилось 85 ЧДБ-детей в возрасте от 5 месяцев до 18 лет, получавших лечение по поводу внебольничной пневмонии. Особенностью отобранных для исследования больных был скомпрометированный преморбидный фон большинства из них. Все пациенты относились к группе часто и длительно болеющих респираторными заболеваниями детей, получали антибактериальную терапию в течение предыдущих трех месяцев, треть из них перенесли пневмонию в течение последнего года.
Всем детям при установлении диагноза пневмонии был назначен Цефодокс из расчета 10 мг/кг массы тела ребенка в сутки в 2 приема после еды. Длительность курса лечения зависела от клинической картины и тяжести заболевания и в среднем составила 10 дней. Кроме этого, всем пациентам назначались муколитические препараты, оральная дезинтоксикационная терапия, физиотерапевтические процедуры. Других антибактериальных средств никто из наблюдаемых детей не получал.
При проведении анализа результатов установлено, что на 3-и — 4-е сутки лечения Цефодоксом отмечено уменьшение признаков общей интоксикации, изменение кашля на влажный, облегчение отхождения мокроты, улучшение сна и аппетита. Температура тела нормализовалась на третьи сутки у 60 % пациентов, на четвертые сутки — у 33,3 % пациентов. Одышка в покое исчезла на вторые сутки у 3,3 % детей, на третьи сутки — у 10 % детей, на четвертые сутки — у 43,3 % детей.
На 7–8-е сутки лечения Цефодоксом интоксикация отсутствовала у 93,3 % пациентов. К концу курса лечения общее состояние 93,3 % детей оценено как удовлетворительное. У некоторых пациентов отмечался редкий продуктивный кашель. У 10,0 % пациентов сохранялось жесткое дыхание. У 93,3 % пациентов нормализовались показатели гемограммы. У всех пациентов биохимические исследования сыворотки крови патологии не выявили.
На 14-й день лечения у 83,3 % пациентов проводилась контрольная рентгенография органов грудной клетки, при которой выявлено полное исчезновение очага инфильтрации легких.
Таким образом, высокая эффективность лечения установлена у 83,3 % пациентов, умеренная эффективность — у 10,0 % пациентов, низкая эффективность — у 3,6 %. «Низкая эффективность» лечения проявлялась:
— у одного ребенка — наличием одышки в покое в течение 8 дней, сохраняющимся малопродуктивным кашлем;
— у другого ребенка — наличием одышки в покое в течение 7 дней, малопродуктивным кашлем, ослабленным дыханием, тахикардией, лейкопенией.
Во время лечения у всех детей отмечена хорошая переносимость Цефодокса. Аллергические реакции при приеме препарата не отмечались.
На 10-й день от начала заболевания выздоровление констатировано у всех детей, получавших Цефодокс.
Учитывая спектр действия цефалоспорина III поколения Цефодокса, чувствительность к нему как грамположительной (стрептококки, стафилококки, гемофильная палочка), так и грамотрицательной микрофлоры, назначение его как стартового антибактериального препарата при лечении пневмонии, наиболее рационально и эффективно:
— детям из группы часто и длительно болеющих, получавших ранее антибиотики, в том числе цефалоспорины I и II генерации;
— детям, перенесшим пневмонию в течение последних 3 месяцев;
— детям из домов ребенка;
— при нозокомиальной пневмонии.
О результатах многоцентрового исследования ЦЕФ-ПРОСТО доложила заведующая кафедрой госпитальной педиатрии и детских инфекционных заболеваний Украинской медицинской стоматологической академии, доктор медицинских наук, профессор Татьяна Александровна Крючко.
Инфекции дыхательных путей — это наиболее часто встречающиеся инфекции в амбулаторной практике. По данным ВОЗ, инфекции дыхательных путей, вызванные большинством разных возбудителей, каждый год уносят жизни 4,5 миллиона людей, среди которых много детей. Всемирная ассоциация легочных заболеваний (World Lung Foundation) опубликовала данные, согласно которым смертность от этих инфекций составляет около 6 %.
Нерациональное использование антибиотиков (в том числе самолечение) приводит к появлению и распространению резистентных штаммов бактериальных возбудителей.
Целями оптимизации современной антибиотикотерапии являются: повышение эффективности, уменьшение токсичности, предотвращение возникновения резистентности, преодоление имеющейся резистентности, фармакоэкономические преимущества.
Выбор антибактериального препарата должен основываться на таких принципах, как высокая природная чувствительность возбудителей к препарату, отсутствие значимой приобретенной резистентности, высокая клиническая эффективность, высокий профиль безопасности, а также отсутствие селекции и распространения резистентных штаммов.
Одной из наиболее распространенных групп антибиотиков являются цефалоспорины. К преимуществам их применения относят:
— широкий антимикробный спектр;
— бактерицидный механизм действия;
— низкая частота резистентности;
— устойчивость к действию многих бета-лактамаз;
— хорошая переносимость и низкая частота побочных эффектов;
— простота и удобство дозирования.
Среди пероральных цефалоспоринов, которые используются сегодня в педиатрической практике, одним из наиболее оптимальных, безопасных и эффективных антибиотиков является Цефодокс (цефподоксима проксетил) — цефалоспорин III поколения.
Для оценки эффективности и безопасности Цефодокса в лечении нетяжелой внегоспитальной пневмонии было проведено проспективное многоцентровое исследование ЦЕФ-ПРОСТО. Объектом исследования стали 225 пациентов в возрасте от 5 месяцев до 18 лет, госпитализированных в педиатрическое отделение с диагнозом нетяжелой внебольничной пневмонии. В исследовании приняли участие клиники Киева, Харькова, Донецка, Днепропетровска, Полтавы, Запорожья, Львова, Симферополя.
Критериями включения пациентов в исследование являлись инфильтрация на прямой обзорной рентгенограмме легких, а также наличие клинических и лабораторных признаков пневмонии (остро начавшиеся лихорадка, кашель, частота дыхания для детей 5–12 мес. — 50–60/мин, 1–5 лет — 40–50/мин, 5–14 лет — 30–40/мин, 14–18 лет — 20–30/мин, перкуторные изменения, лейкоцитоз более 15 · 109/л и/или лейкоцитарный сдвиг влево). В исследовании не принимали участие пациенты с сопутствующими заболеваниями, а также с осложненной пневмонией.
Пациенты получали Цефодокс внутрь по 10 мг/кг/сутки в 2 приема независимо от приема пищи (суспензия) или после еды (таблетки). Продолжительность антибиотикотерапии определялась индивидуально лечащим врачом и составляла 5–10 дней (отмена Цефодокса разрешалась через 48–72 часа после нормализации температуры тела и клинических проявлений пневмонии). Спустя 2 недели после завершения лечения Цефодоксом (на амбулаторном этапе) планировался визит пациента к врачу (финальный осмотр).
Исследование ЦЕФ-ПРОСТО показало высокую (88 %) и умеренную (10,2 %) эффективность Цефодокса (цефподоксима проксетила) в лечении детей, госпитализированных в педиатрические отделения стационаров с диагнозом нетяжелой внебольничной пневмонии. Установлен высокий профиль безопасности Цефодокса (гастроинтестинальные проявления, не требующие отмены препарата, зарегистрированы у 4,5 % детей).
Таким образом, на основании высокой эффективности и хорошей переносимости Цефодокса (цефподоксима проксетила) подтверждена целесообразность использования данного препарата в лечении детей с нетяжелыми внегоспитальными пневмониями.
О принципах антибактериальной терапии синуситов в детском возрасте рассказал профессор кафедры педиатрии № 2 Национального медицинского университета им. А.А. Богомольца, доктор медицинских наук Сергей Петрович Кривопустов.
Острые бактериальные синуситы являются одним из известных осложнений респираторной вирусной инфекции. Кроме того, они сами могут стать причиной очень серьезных осложнений (таких как менингит, эпидуральный, субдуральный, внутримозговой абсцесс, тромбоз кавернозного и верхнего сагиттального синуса, остеомиелит). Своевременно назначенная антибактериальная терапия эффективно устраняет бактериальный инфекционный процесс, предупреждает хронизацию синусита и развитие осложнений. Развитие острого бактериального риносинусита необходимо заподозрить, в частности, при продолжительности ринита более 10 дней, при наличии соответствующих симптомов интоксикации, температурной реакции, гнойной ринореи, локального болевого синдрома, нарушении восприятия запахов, кашля утром после пробуждения ребенка. Основную этиологическую роль в развитии острого бактериального синусита играют S.pneumoniae, H.influenzae и M.catarrhalis. The Sanford Guide to Antimicrobal Therapy (2010 г.) рекомендует в качестве препарата первой линии при данной патологии использовать амоксициллин 90 мг/кг/сут, или амоксициллин/клавуланат, или цефдинир, или цефподоксим, или цефпрозил. Так, цефподоксим (Цефодокс) устойчив к бета-лактамазе, быстро проникает в ткани и образует концентрации, превышающие минимальные подавляющие для основных возбудителей инфекций верхних дыхательных путей, что позволяет избежать распространения инфекции и развития угрожающих жизни осложнений. Многочисленные отечественные и зарубежные клинические исследования подтвердили его эффективность и безопасность в лечении инфекций дыхательных путей у детей.
Таким образом, рациональное применение антибактериальных препаратов в педиатрической практике позволяет получить необходимый клинический эффект, минимизировать риск развития осложнений и развития антибиотикорезистентности микроорганизмов.
Подготовила Татьяна Тлустова