Международный неврологический журнал 5 (59) 2013
Вернуться к номеру
Депрессивные и тревожные расстройства в кардиологии: возможности комбинированной терапии антидепрессантом и антигипоксантом
Авторы: Долженко М.Н. - НМАПО им. П.Л. Шупика, г. Киев
Рубрики: Семейная медицина/Терапия, Кардиология, Неврология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена распространенной, актуальной проблеме в практике врача-интерниста — тревожным и депрессивным расстройствам. Акцентируется внимание на соматической депрессии как частой составляющей у пациентов с хроническими заболеваниями, описана взаимосвязь между сердечно-сосудистыми заболеваниями и депрессивными расстройствами, взаимное влияние этих заболеваний. Подробно изложены вопросы терапии депрессивных расстройств у таких пациентов, показаны преимущества флувоксамина.
Стаття присвячена поширеній, актуальній проблемі в практиці лікаря-інтерніста — тривожним і депресивним розладам. Акцентується увага на соматичній депресії як частій складовій у пацієнтів із хронічними захворюваннями, описаний взаємозв’язок між серцево-судинними захворюваннями й депресивними розладами, взаємний вплив цих захворювань. Докладно викладені питання терапії депресивних розладів у таких пацієнтів, показані переваги флувоксаміну.
The article deals with the common, important problem in the practice of internist — anxious and depressive disorders. Attention is focused on somatic depression as a frequent component in patients with chronic diseases, the relationship between cardiovascular diseases and depressive disorders, the mutual influence of these diseases are described. The problems of therapy of depressive disorders in these patients are detailed, the advantages of fluvoxamine are shown.
депрессивные расстройства, сердечно-сосудистые заболевания, антидепрессанты, флувоксамин.
депресивні розлади, серцево-судинні захворювання, антидепресанти, флувоксамін.
depressive disorders, cardiovascular diseases, antidepressants, fluvoxamine.
 По данным Всемирной организации здравоохранения (ВОЗ), в настоящее время более чем у 110 млн (3–6 %) человек в мире выявлены те или иные клинически значимые тревожно-депрессивные расстройства.
По данным Всемирной организации здравоохранения (ВОЗ), в настоящее время более чем у 110 млн (3–6 %) человек в мире выявлены те или иные клинически значимые тревожно-депрессивные расстройства.
Так, по сведениям EUROASPIRE III, среди 8580 пациентов из 22 европейских стран, которые наблюдались в течение 6 месяцев после госпитализации по поводу ишемической болезни сердца (ИБС), распространенность депрессии варьировала от 8,2 до 35,7 % среди мужчин и от 10,3 до 62,5 % среди женщин. Распространенность тревожных расстройств варьировала от 12,0 до 41,8 % среди мужчин и от 21,5 до 63,7 % у женщин [1].
Наиболее часто депрессивные расстройства развиваются у лиц обоих полов в возрасте 30–40 лет. Депрессивные расстройства у женщин отмечаются в 2 раза чаще, чем у мужчин. До 15 % больных с депрессией совершают суицидальные попытки [2, 3]. В общей популяции депрессивные расстройства встречаются от 5 до 17 % случаев, причем в условиях специализированных психиатрических учреждений амбулаторного звена они составляют примерно 1 %; при массовом обследовании на промышленных предприятиях те или иные депрессивные нарушения обнаруживают уже у 26 % людей, а среди обратившихся к специалистам общей практики — у 68 % [3–6].
Актуальность данной проблемы обусловлена распространенностью аффективных расстройств, их влиянием на качество жизни и социальное функционирование человека, а также высоким уровнем суицидов среди этих больных [7, 8], что приводит к огромному моральному и экономическому ущербу.
К сожалению, по прогнозам количество психических заболеваний будет увеличиваться. К 2020 г. их доля среди всех заболеваний достигнет почти 50 %, что превосходит прогнозируемое повышение сердечно-сосудистых заболеваний и повлечет за собой огромные затраты на лечение [9].
Наиболее распространенным психическим нарушением, которое встречается в практике врача-интерниста, является депрессия. До 80 % больных с данной патологией впервые обращаются за медицинской помощью к терапевтам, при этом она распознается только у каждого четвертого, и только в 50 % случаев назначается адекватная терапия.
Выделяют четыре формы взаимодействия депрессии и соматических заболеваний:
- депрессия может проявляться в виде соматических расстройств (замаскированные, соматические депрессии);
- депрессия может быть следствием соматического заболевания, например инфаркта миокарда или инсульта;
- депрессия и соматическое заболевание могут сосуществовать;
- некоторые лечебные средства (например, антигипертензивные препараты, кортикостероиды) могут способствовать развитию депрессии.
Каковы клинические признаки депрессивного эпизода?
Для врача-интерниста представляет интерес диагностика депрессивного эпизода.
Согласно МКБ-10, наличие 2–3 из нижеперечисленных признаков, сохраняющихся в течение 2 недель, является характерным свидетельством легкого депрессивного эпизода:
- сниженное (подавленное) настроение, не свойственное раньше, наблюдающееся большую часть дня практически ежедневно в течение двух недель и мало меняющееся от внешних обстоятельств;
- отчетливое снижение интересов и удовлетворения от обычно приятной деятельности, утрата способности радоваться, получать удовольствие от жизни;
- повышенная утомляемость, снижение энергичности, снижение работоспособности;
- снижение самооценки и чувства уверенности в себе;
- беспричинное порицание себя или чрезмерное и неадекватное чувство вины;
- мысли о смерти или самоубийстве либо суицидальное поведение;
- мрачное и пессимистичное видение будущего;
- сниженная способность к концентрации внимания, рассеянность, колебания в принятии решений, неуверенность, нерешительность;
- заторможенность или тревожная суетливость (нарушения психомоторики);
- нарушения сна любого типа;
- изменение аппетита (повышение или понижение) с соответствующим изменением массы тела;
- явная утрата либидо.
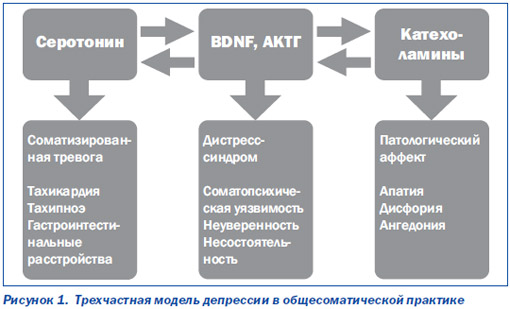
На рис. 1 представлена трехчастная модель депрессий в общесоматической сети. Эта модель, основанная на современных представлениях о патогенезе депрессивных состояний [10], позволяет сопоставить различные проявления аффективного (в частности, депрессивного) расстройства и соответствующие им нейрохимические процессы. Так, часто встречающаяся у больных депрессиями в общесоматической сети соматизированная тревога, которая проявляется тахикардией, потливостью, тахипноэ, гастроинтестинальными расстройствами, дискомфортом в области грудной клетки, может отражать нарушение серотонинергических процессов в ЦНС. Психопатологические расстройства, описываемые в пределах патологической (преимущественно негативной) аффективности (апатия, ангедония, дисфория), вероятно, отражают дисбаланс катехоламинов (норадреналина, дофамина).
Третья составляющая клинической картины депрессий, наблюдающихся в общесоматической практике, — неспецифический дистресс-синдром (сниженная устойчивость к воздействию стрессовых факторов, выраженная утомляемость, неуверенность в своих силах, ощущение собственной несостоятельности) может ассоциироваться с целым рядом взаимодействующих между собой патогенетических процессов. Причем некоторые из них «работают» по типу патологической обратной связи [10].
Вследствие нарушения обмена как серотонина, так и норадреналина с дофамином происходит «перенастройка» критически важных для функционирования нейронов генов. Одни из них перестают «выдавать команду» на синтез нейротрофических факторов (и в частности, так называемого нейротрофического фактора головного мозга — BDNF), необходимых для поддержания жизнедеятельности нейрональных клеток. Другие, напротив, активируют синтез рилизинг-факторов, предопределяющих, в частности, гиперреактивность гипоталамо-гипофизарно-надпочечниковой системы (гиперплазия надпочечников, гиперкортизолемия и т.д.). В свою очередь, это приводит не только к повышению артериального давления, нарушению углеводного обмена, но и к еще большему угнетению BDNF. Наконец, третьи гены инициируют выработку значительного числа «лишних» рецепторов, что усугубляет и без того нарушенный обмен серотонина и катехоламинов [10].
Соматическая депрессия: маска или заболевание?
По данным разных авторов, маскированная (соматическая) депрессия выявляется у 10–30 % всех пациентов с хроническими болезнями. При этом в клинической картине доминируют соматические и вегетативные симптомы, не сопровождающиеся органическими изменениями. Одним из основных этиологических факторов нейроциркуляторной дистонии являются психический стресс, ятрогенный синдром тревоги, неврастенический, ипохондрический, фобический, астенический, истерический, депрессивный синдромы. В данном случае лечение будет неэффективным без применения антидепрессантов.
В то же время депрессии на фоне заболеваний сердечно-сосудистой системы могут квалифицироваться терапевтами как нейроциркуляторные дистонии. Такой кардинальный симптом эндогенной депрессии, как чувство «предсердечной тоски», сложно дифференцировать от приступа стенокардии. Достаточно типичные ангинозные жалобы (колющая, ноющая, сдавливающая боль в области сердца с иррадиацией в левую руку или лопатку) могут быть маской эндогенной депрессии. Болевые симптомы довольно типичны для больных с депрессией (до 60 % случаев). Механизм развития боли (серотонинергический дефицит) связан с депрессией. Такие симптомы соматических расстройств, как легочно-сердечные (тахикардия, аритмия, усиленное сердцебиение, ощущение «перебоев» в работе сердца, гипервентиляция, ощущение недостатка воздуха) и вегетоневрологические (тремор, гипергидроз, похолодание конечностей), часто коррелируют с аффектом тревоги.
Какова взаимосвязь между сердечно-сосудистыми заболеваниями и депрессивными расстройствами?
Между депрессивными расстройствами и заболеваниями сердечно-сосудистой системы существует определенная взаимосвязь. В частности, известно, что наличие депрессии существенно ухудшает комплайенс в отношении терапии сердечно-сосудистой патологии, снижает качество жизни и социальную адаптацию, влияет на показатели течения ИБС в постинфарктном периоде и приводит к более ранней и повышенной смертности [11].
Начало этим исследованиям положил в 1937 г. B. Malzberg. Изучая пациентов с инволюционной меланхолией, он обнаружил 6-кратное увеличение смертности среди этих пациентов в сравнении с общей популяцией и впервые выявил ассоциацию депрессии и смертности с ИБС. В 70-е годы исследователи предложили новые подходы к изучению данной проблемы. Проспективные многолетние исследования здоровых лиц выявили 3–4-кратное увеличение риска развития острых коронарных катастроф у пациентов, перенесших депрессивные расстройства [12, 13]. Оказалось, что эмоциональные расстройства коррелируют с более тяжелым течением соматического страдания и 3-кратным увеличением смертности [14]. Эпидемиологические исследования показали, что частота депрессий на фоне существующей ИБС составляет около 20 %, т.е. каждый пятый пациент с ИБС страдает депрессией [15].
Симптоматические депрессии наиболее часто (40 % больных) наблюдаются при ишемической болезни сердца. Распространенность депрессий в постинфарктном периоде достигает 40–65 %. В 18–25 % случаев у больных в постинфарктном периоде развиваются тяжелые депрессии, которые длятся не менее года [16, 17]. У данной категории больных значительно повышен уровень инвалидизации, суицида, смертности. Так, большое депрессивное расстройство диагностируется у 16 % больных в течение первых 10 дней после острого инфаркта миокарда (ОИМ). В то же время достоверно возрастает смертность больных от сердечной недостаточности после ОИМ с депрессией по сравнению со смертностью больных с сердечной недостаточностью после ОИМ, но без депрессии [18].
В настоящее время нет абсолютной ясности по вопросу о том, почему больные депрессией предрасположены к ИБС. Однако предполагается, что возможным патофизиологическим механизмом такой взаимосвязи могут быть нарушения в свертывающей системе крови. В связи с этим представляют интерес данные о состоянии свертываемости крови у больных с ИБС в сочетании с депрессией. Так, у данной категории больных в 12 раз повышается ТF4 (фактор тромбоцитов 4) и в 4 раза — содержание b-TG (b-тромбоглобулина — маркера повышения «клейкости» тромбоцитов). Вероятно, тенденция к повышению агрегации тромбоцитов (значительное повышение уровней TF4 и b-TG) является одной из биологических характеристик депрессии. Возможно, что эти изменения могут объяснить высокую частоту развития ИМ у больных депрессией, однако это требует доказательств [19]. Установлено, что у пациентов с депрессией имеются значительные дефекты физиологических характеристик тромбоцитов, такие как повышенный уровень внутриклеточного свободного кальция, гиперчувствительность серотониновых (5-HT) и катехоламиновых рецепторов, гиперпродукция фактора 4 и b-тромбоглобулина. Эти особенности предрасполагают к повышенной вазоконстрикции, а также способствуют более активной агрегации тромбоцитов. Повышенный уровень катехоламинов в крови, характерный для больных с тревогой и депрессией, в свою очередь, повышает риск активации тромбоцитов, процессов агрегации и дальнейшего тромбообразования, тесно связанных с развитием острых коронарных синдромов [20, 21].
Какое влияние депрессия оказывает на течение и прогноз ИБС?
Депрессия не только является фактором риска развития ИБС, но и значительно отягощает клиническое течение ИБС, а также влияет на прогноз заболевания. Результаты исследований свидетельствуют, что больные ИБС с депрессией чаще жалуются на приступы стенокардии, ограничения физической активности, имеют низкий функциональный статус, более низкое качество жизни. Они реже возвращаются к трудовой деятельности после перенесенного ИМ или аортокоронарного шунтирования (АКШ), чем пациенты без депрессии.
При изучении влияния депрессии на прогноз ИБС установлено, что депрессия является мощным независимым предиктором смертности у больных с установленной ИБС. По данным разных авторов, уровень смертности у больных, перенесших ИМ и страдающих депрессией, в 3–6 раз выше, чем у больных, перенесших ИМ и не имеющих признаков депрессии [22].
Прослеживается коморбидность депрессивного расстройства и постинфарктных состояний в 4 вариантах взаимоотношений:
- возникновение ИМ на фоне существующей и/или предшествующей депрессии — 35,1 %;
- одновременное появление ИМ и депрессии — 21,1 %;
- депрессии, развившиеся в раннем постинфарктном периоде (до 1 мес.) — 10,5 %;
- депрессии, возникшие в восстановительном периоде ИМ — 33,3 % наблюдений.
Значимость депрессии в качестве предиктора сердечно-сосудистых катастроф носит более акцентуированный характер у больных с аритмиями, а также у пожилых больных ИБС. В частности, установлено, что если у 70-летнего мужчины диагностируется депрессия, то вероятность сердечно-сосудистой катастрофы у него почти в 2 раза выше, чем у мужчины того же возраста без депрессии [23].
Важно отметить, что негативное влияние на прогноз оказывает не только так называемая большая депрессия, но и депрес-сия легкой степени тяжести. Доказано, что у пациентов с подтвержденной на коронароангиографии ИБС наличие депрессивного расстройства является предиктором развития ОКС в течение 12 месяцев. Достоверно значимо увеличена кумулятивная смертность у больных с депрессией по сравнению с больными без депрессии, что сопровождалось снижением вариабельности сердечного ритма и развитием витальных аритмий [24].
Депрессия ассоциируется с высокой смертностью от СН у больных после ИМ. Так, 20,7 % пациентов имели депрессивный эпизод перед ИМ, что сопровождалось ухудшением состояния вследствие развития СН. В исследовании у пациентов с сердечной недостаточностью депрессия имела статистически достоверное влияние на смертность независимо от других факторов (РР 1,33; 95% ДИ 1,06–1,66) [25]. Больные с проявлениями депрессии пожилого возраста показывают значительно худшие результаты теста с 6-минутной ходьбой по сравнению с больными без депрессии [23].
Американская ассоциация сердца рекомендует рутинное скринирование депрессий у больных с ИБС [26].
Механизмы отрицательного влияния депрессии на прогноз ИБС изучены пока недостаточно. Однако показано, что помимо дефектов физиологических характеристик тромбоцитов у больных депрессией отмечается снижение контроля за частотой сердечных сокращений и сердечным ритмом как следствие нарушенного баланса в автономной нервной системе. При проведении больным с депрессивными и тревожно-депрессивными расстройствами холтеровского мониторирования ЭКГ обнаружена сниженная вариабельность сердечного ритма. Причем степень снижения вариабельности сердечного ритма коррелирует с выраженностью симптоматики: чем более выражена депрессия у больных ИБС, тем у них более низкая вариабельность сердечного ритма [27]. Между тем известно, что пониженная вариабельность сердечного ритма, отражающая пониженный парасимпатический тонус, приводит к несбалансированной симпатической стимуляции сердца, что предрасполагает к развитию желудочковых аритмий, повышенной адгезивности тромбоцитов и может явиться причиной повышенной сердечно-сосудистой смертности. Свидетельством того, что у больных депрессией нарушен контроль со стороны автономной нервной системы, являются данные, что у больных ИБС с депрессией снижена барорецепторная чувствительность. Еще один механизм, объясняющий связь между депрессией и повышенной смертностью у больных ИБС, — это влияние депрессии на приверженность (комплайенс) больных к лечению. Установлено, что при наличии депрессии больные ИБС реже придерживаются здорового образа жизни, хуже выполняют врачебные рекомендации по соблюдению диеты, отказу от курения, режиму физической активности, необходимости ограничения алкоголя. Наличие депрессивной и тревожно-депрессивной симптоматики отрицательно влияет и на приверженность больных к рекомендованной кардиологом медикаментозной терапии. У больных ИБС, страдающих депрессией, затруднено проведение реабилитации и мероприятий по вторичной профилактике [28].
Представленные данные, свидетельствующие об утяжелении на фоне депрессии течения ИБС, ухудшении прогноза заболевания, диктуют необходимость своевременного распознавания и лечения депрессии у данной категории больных. К сожалению, в большинстве случаев депрессия у больных ИБС своевременно не диагностируется и не лечится. Причина такой ситуации заключается в том, что, как правило, у больных ИБС наблюдаются скрытые, маскированные депрессии. При такой депрессии отсутствуют характерные для типичной депрессии суицидальные мысли или намерения. Больные могут даже не предъявлять собственно депрессивных жалоб, таких как подавленное настроение, утрата интересов или чувства удовольствия. В клинической картине маскированной депрессии преобладает соматическая и вегетативная симптоматика. Чаще всего масками депрессии являются различные нарушения сна (трудности засыпания, раннее пробуждение или повышенная сонливость), нарушения аппетита (выраженное снижение или повышение), изменения массы тела, повышенная утомляемость и раздражительность, пониженная активность и работоспособность, хронический болевой синдром различной локализации (чаще всего кардиалгии, головные боли, боли в спине), вегетативные расстройства (нередко в виде приступов сердцебиения, одышки, головокружения и пр.), различные нарушения в сексуальной сфере. У части больных снижена самооценка, отмечаются трудности в концентрации внимания и в принятии решений, имеется ощущение собственной бесполезности. При более подробном расспросе больного, как правило, удается обнаружить и собственно депрессивные симптомы [29].
Приведенные данные свидетельствуют о необходимости решения вопросов интегральной медицины, лечения кардиологических заболеваний у больных с психической патологией и, что является основной проблемой на сегодняшний день, о влиянии нарушений психики на развитие и ухудшение течения сердечно-сосудистой патологии.
Какие существуют современные фармакологические методы лечения тревожно-депрессивных расстройств у больных с кардиоваскулярной патологией?
Врач-кардиолог может проводить лечение больных с впервые возникшими депрессивными расстройствами легкой и умеренной степени тяжести при отсутствии суицидальных мыслей и поведения, психотической симптоматики, а также отсутствии противопоказаний по соматическому состоянию для назначения современных антидепрессантов.
Основными критериями при выборе антидепрессантов наряду с терапевтической эффективностью являются безопасность, хорошая переносимость, отсутствие тяжелых побочных эффектов, минимальный риск нежелательных взаимодействий с соматотропными препаратами.
Классификация антидепрессантов:
- ингибиторы моноаминоксидазы: ипрониазид, ниаламид, фенелзин;
- трициклические антидепрессанты: амитриптилин, имипрамин, кломипрамин, доксепин;
- селективные ингибиторы обратного захвата серотонина (СИОЗС): сертралин, флуоксетин, флувоксамин, циталопрам, пароксетин;
- селективные ингибиторы обратного захвата норадреналина: миансерин, мапротилин, миртазапин;
- эквипотенциальные селективные ингибиторы обратного захвата серотонина и норадреналина: венлафаксин, милнаципран;
- селективные стимуляторы обратного захвата серотонина: тианептин.
Антидепрессантами первого ряда у больных с сердечно-сосудистыми заболеваниями, а также у пожилых больных считаются селективные ингибиторы обратного захвата серотонина. Препараты этой группы тормозят обратное проникновение серотонина из синаптической щели внутрь пресинаптического нейрона (в настоящее время общепринятой является нейробиохимическая серотонинергическая концепция патогенеза депрессии) и не оказывают существенного влияния на другие нейромедиаторы. Свое название СИОЗС получили из-за своей большей селективности в отношении блокирования обратного захвата серотонина, чем обратного захвата норадреналина (по меньшей мере в 10 раз). Кроме того, СИОЗС имеют незначительное сродство к a1-адренорецепторам, М-холинорецепторам, гистаминовым Н1-рецепторам, что обеспечивает их хорошую переносимость. СИОЗС в отличие от трициклических антидепрессантов не обладают способностью к блокированию медленных натриевых каналов, в связи с чем они более безопасны при передозировке. Еще одним достоинством СИОЗС является удобство их применения: возможность проведения лечения фиксированными дозами или минимальная потребность в титрации, благоприятная фармакокинетика, позволяющая принимать их однократно в сутки и таким образом повышать приверженность пациентов к лечению [30].
Препараты СИОЗС существенно различаются между собой по степени селективности блокады обратного захвата серотонина, по мощности данного действия и, наконец, по своим клинико-фармакологическим эффектам и профилю безопасности.
Важнейшим критерием выбора антидепрессанта (и в частности, СИОЗС) у пациентов с кардиоваскулярной патологией является возможность коррекции с его помощью депрессии, тревоги, фобий и когнитивных расстройств в сочетании с благоприятным влиянием на соматовегетативные функции. Именно в этом плане особого внимания заслуживает один из наиболее перспективных препаратов СИОЗС — флувоксамин.
Флувоксамин — препарат СИОЗС с весьма специфическим спектром клинико-фармакологических эффектов, существенно отличающим его от других препаратов данной группы. К основным из упомянутых эффектов следует отнести:
1) выраженное тимоаналептическое действие;
2) выраженное анксиолитическое действие в сочетании с мягким психостимулирующим эффектом;
3) благоприятное влияние на когнитивную сферу;
4) безопасность [31, 32].
Известно, что недавно в ЦНС были выявлены специфические сигма-рецепторы, модулирующие активность NMDA-глутаматных рецепторов и, соответственно, глутаматную нейромедиацию, играющую важную роль в процессах памяти и обучения, а также в реакциях высвобождения дофамина и ряда нейропептидов [33, 34]. Плотность данных рецепторов особенно высока в гиппокампе и различных ядрах таламуса, т.е. в структурах, непосредственно вовлеченных в реализацию когнитивных функций [12]. По современным представлениям, агонисты сигма-рецепторов обладают самостоятельными свойствами активаторов когнитивных процессов, антидепрессивным и нейропротекторным действием и т.д. [35, 34]. Следует отметить, что флувоксамин обладает наивысшим сродством к сигма-рецепторам среди всех препаратов СИОЗС [36], вследствие чего он является наиболее эффективным инструментом коррекции всех видов когнитивных расстройств при депрессиях.
Известно благоприятное влияние флувоксамина на процессы нейропластичности и нейрогенез в гиппокампе и медиафронтальной зоне коры [37], т.е. в регионах ЦНС, играющих ключевую роль в поддержании психоэмоционального состояния и развитии депрессий. В целом как антидепрессант флувоксамин обладает сбалансированным комплексным клинико-фармакологическим эффектом, оптимально сочетающим тимоаналептическое, анксиолитическое и психостимулирующее действие.
Особенно ценным представляется факт сочетанного собственно анксиолитического и соматовегетативного действия флувоксамина (устранение симптомов психической тревоги параллельно с ее соматическими коррелятами (диспепсия, сердцебиение, гипервентиляция, потливость и т.д.)). Последующее нарастание упомянутых эффектов отмечалось на протяжении 4–8 недель лечения. Психостимулирующий компонент действия флувоксамина проявляется несколько позднее (на 2-й неделе), нарастает постепенно и в целом менее выражен, чем тимоаналептический и анксиолитический.
Характерным для данного препарата также можно считать отсутствие выраженной седации, вялости и сонливости, присущих амитриптилину, даже на фоне выраженного анксиолитического эффекта и проявление стимулирующего действия без симптомов гиперстимуляции и растормаживания.
Флувоксамин характеризуется весьма благоприятными для представителя СИОЗС параметрами безопасности. Он не оказывает влияния на сердечно-сосудистую систему и проявляет минимальное (по сравнению с другими СИОЗС) воздействие на сексуальную функцию. Побочные эффекты флувоксамина в основном сходны с таковыми для СИОЗС в целом (диспептические расстройства, головокружение, слабость, сердцебиение, беспокойство), однако встречаются реже и менее выражены [31, 38].
На сегодняшний день заслуживает внимания появление в Украине нового препарата флувоксамина Депривокс производства «Стада Арцнаймиттель АГ», Германия.
Немаловажную роль при заболеваниях как головного мозга, так и миокарда играет дефицит кислорода, приводящий к ограничению аэробного образования энергии вследствие нарушения энергосинтезирующей функции дыхательной цепи митохондрий. В конечном итоге происходят накопление активных форм кислорода, истощение запасов эндогенных антиоксидантов и активация перекисного окисления липидов клеточных мембран. Одними из наиболее перспективных препаратов группы антиоксидантов являются производные 3-оксипиридина, способные проникать через гематоэнцефалический барьер [39]. Проявляя антиоксидантные свойства, этилметилгидроксипиридина сукцинат (Мексиприм производства «Стада Арцнаймиттель АГ», Германия) угнетает процессы свободнорадикального окисления, перекисного окисления липидов, а с другой стороны, активируя супероксиддисмутазу, повышает активность физиологической антиоксидантной системы в целом. Мексиприм вызывает усиление компенсаторной активации аэробного гликолиза и снижение степени угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активацию энергосинтезирующих функций митохондрий, стабилизацию клеточных мембран, что является важным для нормального функционирования миокарда. Кроме того, антигипоксическое действие Мексиприма связано с входящим в его состав сукцинатом, который в условиях гипоксии, поступая во внутриклеточное пространство, способен окисляться дыхательной цепью. Активация сукцинатоксидазного пути окисления в условиях гипоксии способствует повышению резистентности клеток миокарда к дефициту кислорода [40].
С другой стороны, Мексиприм обладает ноотропным действием, что обусловлено его влиянием на физико-химические свойства мембраны, при этом ее вязкость уменьшается и увеличивается текучесть, в результате происходит возрастание ее функциональной активности. Это приводит к конформационным изменениям синаптических мембран, вследствие чего проявляется модулирующее действие Мексиприма на активность мембраносвязанных ферментов, ионных каналов и рецепторных комплексов, в том числе бензодиазепинового, ГАМК, ацетилхолинового, усиливается их способность связывания с лигандами, повышается активность нейромедиаторов и активация синаптических процессов, также важно отметить повышение содержания в головном мозге дофамина. Препарат может воздействовать на когнитивные симптомы сосудистой депрессии, которые наиболее плохо отвечают на применение антидепрессантов. Собственно, его анксиолитический эффект и является основным помощником врача при лечении пограничных тревожно-депрессивных и вегетативных расстройств [41, 42].
Таким образом, терапия когнитивных нарушений, развивающихся вследствие тревожно-депрессивных и неврологических расстройств, обусловленных атеросклерозом и артериальной гипертензией у больных с хроническими нарушениями мозгового кровообращения, требует применения препаратов, обладающих вазоактивными, психостимулирующими и ноотропными свойствами [39, 40].
Учитывая вышесказанное, актуальной является комбинированная терапия антидепрессантом Депривокс и антигипоксантом Мексиприм у пациентов с тревожно-депрессивными состояниями на фоне кардиоваскулярной патологии.
Заключение
Согласно закону Украины «О психиатрической помощи» от 22.02.2000 г. № 1489-III диагноз психического расстройства может ставить только врач-психиатр. Но, как показывает практика, для кардиолога и особенно кардиохирурга являются важными вопросы своевременной первичной диагностики психических расстройств у кардиологических больных.
Таким образом, знание предикторов, механизмов развития и особенностей клиники депрессивного эпизода у больных с сердечно-сосудистой патологией помогает кардиологу в стратификации больных с психопатологическими состояниями, что улучшает прогноз основного соматического заболевания, а учитывая проявления пред- и постоперационного стресса при проведении операции АКШ, можно снизить постоперационную летальность и сохранить социальную адаптацию больного.
В то же время при современных возможностях психофармакологии грамотно проведенное лечение позволяет не просто сократить продолжительность депрессивного эпизода, облегчить страдания, не допустить суицида, но и сохранить качество жизни и полноценное социальное функционирование больных.
1. Pająk A., Jankowski P., Kotseva K. Depression, anxiety, and risk factor control in patients after hospitalization for coronary heart disease: the EUROASPIRE III Study // European Journal of Preventive Cardiology April. — 2013. — Vol. 20. — № 2331-340.
2. Дмитриева Т.Б. (ред.) Клиническая психиатрия: Пер. с англ. доп. — Москва: ГЭОТАР, 1998. — 512 с. (H.I. Kaplan, Sadock B.J. Pocket handbook of clinical psychiatry. — Baltimore: Williams & Wilkins).
3. Мосолов С.Н., Калинин В.В. Некоторые закономерности формирования, коморбидность и фармакотерапия тревожно-фобических расстройств // Тревога и обсессии / Под ред. А.Б. Смулевича. — М., 1998. — С. 217-228.
4. Марута Н.А., Мороз В.В. Невротические депрессии (клиника, патогенез, диагностика и лечение). — Харьков: Арис, 2002. — 144 с.
5. Михайлов Б.В. Проблема депрессий в общесоматической практике // Международный медицинский журнал. — 2003. — Т. 9, № 3. — С. 22-27.
6. Самушия М.А., Вечеринина К.О. Патохарактерологические нарушения в отдаленном послеоперационном периоде аортокоронарного шунтирования (клиника и терапия) // Психиатрия и психофармакотерапия. — Т. 7. —№ 4. — 2005. — С. 14-18.
7. Гойда Н.Г., Жданова Н.П., Напрєєнко О.К., Домбровська В.В. Психіатрична допомога в Україні у 2001 році та перспективи її розвитку // Український вісник психоневрології. — 2002. — Т. 10, вип. 2. — С. 9-12.
8. Иванов С.В., Сыркин Л.А., Самушия М.А. Расстройства личности в послеоперационном периоде аортокоронарного шунтирования // Журнал неврологии и психиатрии им. С.С. Корсакова. — № 12. — 2004. — С. 12-16.
9. Kasper S., Lepine J.P., Mendlewicz J., Montgomery S.A., Rush A.J. Efficacy, safety, and indications fortricyclic and newer antidepressants // Depression. 1995.— 2. — P. 127-137.
10. Дробижев М.Ю. Лечение депрессий в общесоматической сети // Психиатрия и психотерапия. — 2003. — Т. 5, № 5. — С. 8-12.
11. Musselman D.L., Evans D.L., Nemeroff C.B. et al. The relationship of depression to cardiovascular disease // Arch. Gen. Psychiatry. — 1998. — 55. — 580-592.
12. Корнетов Н.А., Лебедева Е.В. Депрессивные расстройства у пациентов, перенесших инфаркт миокарда // Психиатрия и психотерапия. — 2003. — Том 5, № 5. — С. 10-15.
13. Barefoot J.C., Schroll M. Symptoms of depression, acute myocardial infarction, and total mortality in a community sample // Circulation. — 1996. — 93. — 1976-1980.
14. Frasure-Smilh N. Lesperance F. Talajic M. Depression following myocardial infarction: impact on 6-month survival // JAMA. — 1993. — 270. — 1813-1825.
15. Lane D., Carroll D., Ring C. et al: Mortality and quality of life 12 months after inyocardial infarction: effects of depression and anxiety // Psychosom. Med. — 2001. — 63. — 221-230.
16. Sheps D.S., Sheffield D. Depression Anxiety, and the Cardiovascular System: The Cardiologist’s Perspective // J. Clin. Psychiatry. — 2001 — 62 (suppl. 8). — P. 12-16.
17. Sheps DS, McMahon RP, Light KC, et al. 1ow hot pain threshold predicts shorter time to exercise induced angina: results from the Psychophysiological Investigations of Myocardial Ischemia (PIMI)study // J. Am. Coll Cardiol. — 1999. — 33. — 1855-1862.
18. Frasure-Smith N., Lesperanee F., Talajic M. Depression and 18-month prognosis after myocardial infarction // Circulation. — 1995. — 91. — 999-1005.
19. Frasure-Smith N., Lesperance F., Juneau M. et al. Gender, depression, and one-year prognosis after myocardial infarction // Psychosom. Med. — 1999. — 61. — 26-37.
20. Hemingway H., Marmot M. Evidence based cardiology: psychosocial factors in the aetiology and prognosis of coronary heart disease: systematic review of prospective cohort studies // BMJ. — 1999. — 318. — 1460-1467.
21. Irvine J., Basinski A., Baker B. et al. Depression and risk of sudden cardiac dealh after acute myocardial infarction: testing for the confounding effects of fatigue // Psychosom. Med. — 1999. — 61. — 729-737.
22. ENRICHD Investigators: Enhancing Recovery in Coronary Heart Disease (ENRICHD) study intervention: rationale and design // Psychosom. Med. — 2001. — 63. — 747-755.
23. Baldasseroni S., Pratesi A., Orso F. et al. Age-related impact of depressive symptoms on functional capacity measured with 6-minute walking test in coronary artery disease // European Journal of Preventive Cardiology. — 2013. — June 20.
24. Lane D., Carroll D., Ring C. et al: Mortality and quality of life 12 months after inyocardial infarction: effects of depression and anxiety // Psychosom. Med. — 2001. — 63. — 221-230.
25. O’Connor Ch., Jiang W., Kuchibhatla M. et al. Antidepressant Use, Depression, and Survival in Patients With Heart Failure // Intern. Med. — 2008. — 168(20). — 2232-2237.
26. Lichtman J.H., Bigger Jr J.T., Blumenthal J.A. et al. Depression and coronary heart disease. Recommendations for screening, referral, and treatment. A science advisory from the Prevention Committee of the American Heart Association Cardiovascular Nursing Council, Clinical Cardiology Council, Epidemiology and Prevention Council, and Interdisciplinary Council on Quality of Care and Outcome Research // Circulation. — 2008. — 118. — 1768-1772.
27. Krittayaphong R., Cascio W.E., Eight K.C. et al. Heart rate variability in pa tients with coronary artery disease: differences in patients with higher and lower depression scores // Psychosom. Med. — 1997. — 59. — 231-235.
28. Lane D., Carroll D., Ring C. et al: Mortality and quality of life 12 months after inyocardial infarction: effects of depression and anxiety // Psychosom. Med. — 2001. — 63. — 221-230.
29. Dickens C.M., McGowan I., Percival C. et al. Lack of a close confidant, but not depression, predicts further cardiac events after myocardial infarction // Heart. — 2004. — 90. — 518-522.
30. Смулевич А.Б. Клинико-фармакологические эффекты антидепрессантов // Психиатрия и психофармакотерапия. — 2003. — Т. 5, № 1. — С. 2-4.
31. Бурчинский С.Г. Флувоксамин и его возможности в современной психофармакотерапии // Журнал практ. лікаря. — 2008. — № 1. — С. 42-47.
32. Dalery J., Honig A. Fluvoxamine versus fluoxetine in major depressive episode: a double-blind randomized comparison // Hum. Psychopharmacol. — 2003. — V. 18. — P. 379-384.
33. Bouchard P., Quirion R. [3H] 1,3-di (2-totyl) guanidine and[3H](+) pentazocine binding sites in the rat brain: autoradiographic visualization of the putative sigma 1 and sigma 2 receptor subtypes // Neuroscience. — 1997. — V. 76. — P. 467-477.
34. Maurice T., Phan V.L., Privat A. The anti-amnesic effects of sigma 1 receptor agonists confirmed by in vivo antisense strategy in the mouse // Brain Res. — 2001. — V. 898. — P. 113-121.
35. Bermarck J.Е., Debonnel G. Modulation of serotoninergic neurotransmission by short- and long-term treatment with sigma-ligands // Brit. J. Pharmacol. — 2001. — V. 134. — P. 691-699.
36. Carrasco J.L., Sandner C. Clinical effects of pharmacological variations in selective serotonin reuptake inhibitors: an overview // Int. J. Clin. Pract. — 2005. — V. 59. — P. 1428-1434.
37. Ohashi S., Togashi H., Matsumoto M. et al. Changes in synaptic properties in cortical-limbic communications induced by repeated treatments with fluvoxamine in rats // J. Pharmacol. Sci. — 2003. —V. 92. — P. 100-107.
38. Цыбина М.И. Опыт клинического применения амитриптилина, флувоксамина и тианептина в терапии депрессивных расстройств // Психиатрия и психофармакотерапия. — 2000. — Т. 2, № 6. — С. 49-53
39. Мищенко Т.С., Деревецкая В.Г., Перцева Т.Г., Джандоева Н.Ш. Новые возможности в лечении больных с умеренными когнитивными нарушениями // Новости медицины и фармации. Спецвып. Неврология. — 2010. — 339.
40. Силина Е.В., Румянцева С.А., Болевич С.Б., Меньшова Н.И. Закономерности течения свободнорадикальных процессов и прогноз ишемического и геморрагического инсульта // Журнал неврологии и психиатрии. Инсульт. — 2011. — № 12. — С. 36-42.
41. Кшова И.И., Лагода О.В., Родионова Ю.В., Танашян М.М., Федин П.А. Антиоксидантная терапия хронических цереброваскулярных заболеваний // Русский медицинский журнал. Неврология. Психиатрия. — 2010. — № 10. — С. 487.
42. Шавловская О.А. Эффективность препаратов антиоксидантного типа действия в терапии легких и умеренных когнитивных расстройств // Русский медицинский журнал. Неврология. — 2013. — № 10. — С. 476.

