Журнал «» 3 (35) 2014
Вернуться к номеру
Нужны ли споры на тему: лучше сартаны или ингибиторы АПФ? (часть 2)
Авторы: Радченко А. Д. - ГУ «ННЦ «Институт кардиологии имени акад. Н.Д. Стражеско» НАМН Украины
Рубрики: Семейная медицина/Терапия, Кардиология
Разделы: Медицинское образование
Версия для печати
Представленная статья является обзором данных литературы о влиянии блокаторов рецепторов ангиотензина II на частоту развития кардиоваскулярных событий. Сравнивается их эффективность в предупреждении возникновения осложнений с ингибиторами ангиотензинпревращающего фермента. Проводится сопоставление переносимости и безопасности использования блокаторов рецепторов ангиотензина II и ингибиторов ангиотензинпревращающего фермента. Делаются выводы, что существенной разницы, которая бы имела клиническое значение, между блокаторами рецепторов ангиотензина II и ингибиторами ангиотензинпревращающего фермента нет.
Представлена стаття є оглядом даних літератури щодо впливу блокаторів рецепторів ангіотензину ІІ на частоту виникнення кардіоваскулярних подій. Проводиться зіставлення з дією інгібіторів ангіотензинперетворюючого ферменту. Розглядаються питання зіставлення переносимості та безпечності інгібіторів ангіотензинперетворюючого ферменту та блокаторів рецепторів ангіотензину ІІ. Робляться висновки, що клінічно значущих відмінностей між блокаторами рецепторів ангіотензину ІІ та інгібіторами ангіотензин-перетворюючого ферменту немає.
This paper is a review of the literature data on the impact of angiotensin II receptor blockers on the incidence of cardiovascular events. We compared their efficacy in the prevention of complications with angiotensin-converting enzyme inhibitors. The comparison of tolerability and safety of angiotensin II receptor blockers and angiotensin-converting enzyme inhibitors use is being carried out. Conclusions were made that there is no significant difference, that would have clinical significance, between angiotensin II receptor blockers and angiotensin-converting enzyme inhibitors.
ингибиторы ангиотензинпревращающего фермента, сартаны, эффективность, безопасность.
інгібітори ангіотензинперетворюючого ферменту, сартани, ефективність, безпека.
angiotensin-converting enzyme inhibitors, sartans, efficiency, safety.
Статья опубликована на с. 103-117
Как указывалось в предыдущей части обзора данных литературы [1], в течение как минимум последних десяти лет длятся споры о том, что предпочтительнее для пациентов с кардиоваскулярными заболеваниями — блокаторы рецепторов ангиотензина II (БРА) или ингибиторы ангиотензинпревращающего фермента (иАПФ). Значительно раньше появились иАПФ, и завоевание рынка кардиоваскулярных препаратов шло достаточно долго. БРА появились позднее и очень быстро вошли в клиническую практику. Этому во многом способствовало то, что эта группа, так же как и иАПФ, относится к блокаторам ренин-ангиотензиновой системы (РАС), и считается, что где эффективно применение одного препарата, там и другой будет работать хорошо. Кроме того, достаточно быстро был проведен ряд больших рандомизированных клинических исследований, которые доказали, что БРА могут быть препаратами первой линии в терапии АГ и не уступают иАПФ в лечении больных нефропатией, сердечной недостаточностью (СН) и постинфарктных пациентов с признаками СН или систолической дисфункции [2]. Более широкое использование БРА сдерживалось высокой ценой на эти препараты, но ситуация изменилась, когда появились генерические средства. В некоторых странах БРА стали назначаться даже чаще, чем иАПФ, что обусловило появление споров о преимуществах одних и недостатках других. В нашей стране БРА назначаются значительно реже, чем иАПФ, но вопросы о том, что лучше, продолжают обсуждаться в литературе и на конференциях. В предыдущей части данного обзора рассматривался вопрос о различиях между БРА и иАПФ в снижении АД и протекции органов-мишеней. Данная статья посвящена сравнительной оценке влияния этих классов антигипертензивных препаратов на частоту развития кардиоваскулярных событий и побочных явлений.
Одинаково ли предупреждают сердечно-сосудистые события иАПФ и БРА?
В 2004 году были опубликованы два метаанализа. В одном из них V.C. Lee с соавторами отмечают, что у пациентов с СН и высоким риском возникновения инфаркта миокарда (ИМ) прием БРА способствовал снижению смертности от всех причин и госпитализаций по поводу СН по сравнению с плацебо и не обнаружилось различий между влиянием БРА и иАПФ на какие бы то ни было конечные точки [37]. В другом метаанализе G. Strippoli с соавторами утверждали, что при диабетической нефропатии иАПФ существенно и достоверно уменьшали общую смертность (OR = 0,79, P = 0,04), в то время как БРА на общую смертность не влияли (OR = 0,99, P = 0,95) [61].
Еще раньше метаанализов появились результаты исследований VALUE и CHARM-Alternative [28, 32, 81]. В исследовании VALUE, включавшем пациентов высокого риска с АГ, группа получавших лечение на основе БРА валсартана достоверно не отличалась от группы получавших амлодипин по частоте развития первичной конечной точки (кардиоваскулярная смертность и заболеваемость), но частота развития ИМ и инсульта была существенно более высокой в группе валсартана — на 19 и 13 % соответственно (р = 0,02 и 0,08) [32]. При этом отмечалась разница в достигнутом АД: пациенты, получавшие амлодипин, имели на 1,8/1,5 мм рт.ст. более низкое систолическое/диастолическое АД [81]. В исследовании CHARM-Alternative, несмотря на снижение АД в большей степени (ΔСАД/ДАД = 4,4/3,9 мм рт.ст.), отмечалось увеличение частоты развития ИМ у пациентов с СН, которые не переносили иАПФ и получали кандесартан, на 36 % по сравнению с больными, получавшими плацебо [28]. При этом в исследованиях CHARM-Preserved и CHARM-Added не отмечалось такого влияния на частоту развития ИМ [27, 45, 51, 83]. При анализе всех ветвей исследования CHARM применение кандесартана в целом не увеличивало частоту развития ИМ (OR = 0,92, НД) [51].
В других 7 исследованиях с применением БРА, результаты которых были опубликованы к ноябрю 2004 года, не было отмечено достоверного увеличения частоты развития ИМ при приеме БРА. Тем не менее в ноябре 2004 года появляется комментарий двух канадских исследователей, S. Verma и M. Strauss, в журнале British Medical Journal под названием «Блокаторы рецепторов ангиотензина и инфаркт миокарда. Данные препараты могут повышать частоту развития инфаркта миокарда — и пациенты должны знать об этом» [77]. В комментариях авторы выражают сомнение, что столь выраженное увеличение частоты развития ИМ в исследовании VALUE можно объяснить лишь разницей в уровне АД (это, скорее, было бы справедливо для инсульта), тем более что в исследовании CHARM-Alternative отмечалась более существенная разница в уровне достигнутого АД в пользу кандесартана по сравнению с плацебо, но тем не менее частота ИМ была достоверно выше именно в группе пациентов, получавших БРА. А в исследовании CHARM-Preserved разница в снижении АД достигла 7/3 мм рт.ст. по сравнению с плацебо, но достоверного снижения частоты ИМ не наблюдалось, а смертность и частота госпитализаций по поводу СН снизились всего на 13 и 11 % соответственно. В исследовании SCOPE [39] кандесартан снизил АД на 3,2/1,6 мм рт.ст. по сравнению с плацебо, однако частота развития ИМ была недостоверно выше на 10 %. В исследовании LIFE [14, 38] пульсовое АД было на 1,7 мм рт.ст. ниже в группе лиц, получавших лозартан, однако не наблюдалось достоверного снижения частоты развития ИМ. В исследованиях RENAAL [10] и IDTNT (IRMA) [50] БРА достоверно уменьшали прогрессирование нефропатии у больных с нефропатией и сахарным диабетом 2-го типа, но достоверно не влияли на частоту развития кардиоваскулярных событий, от которых в 30 и 24 % случаев соответственно умирали пациенты, включенные в исследование. Более того, ирбесартан недостоверно на 36 % увеличивал частоту развития ИМ, несмотря на снижение АД. При этом авторы отмечают, что иАПФ в среднем на 20 % уменьшают частоту развития ИМ у пациентов с сахарным диабетом, АГ, почечной недостаточностью и атеросклерозом [9, 74, 75]. В заключение они задают вопрос: нужно ли сообщать пациенту при назначении БРА, в особенности валсартана, о повышенном риске развития ИМ? Возможно, говорят они, что результаты исследования ONTARGET/TRANSCEND позволят ответить на этот вопрос.
После данной публикации каждый год в средствах массовой информации начинали появляться комментарии, метаанализы, интервью, которые либо поддерживали, либо опровергали утверждения канадских исследователей. В марте/апреле 2005 года в журнале Cariovascular Journal of South Africa печатаются комментарии известного специалиста в фармакотерапии сердечно-сосудистых заболеваний профессора L. Opie [49] и профессоров J. Ker и P. Rheeder [35]. J. Ker и P. Rheeder провели метаанализ результатов всех исследований с участием БРА, в том числе и предыдущих метаанализов, и не обнаружили достоверного отрицательного влияния БРА на развитие ИМ (RR = 1). L. Opie указывает на то, что, согласно его метаанализу, риск развития ИМ на фоне приема БРА составляет 1,046 (НД), что сравнимо с увеличением на 5 % частоты возникновения ИМ на фоне приема лизиноприла в исследовании ALLHAT [4]. Его удивляло, что S. Verma и M. Strauss не упомянули, что в исследовании CHARM наблюдалось достоверное снижение общей смертности и комбинированной конечной точки (кардиоваскулярная смерть, госпитализация по поводу СН, нефатальный ИМ). Что касается метаанализа при нефропатиях, то G. Strippoli с соавторами свои выводы о положительном влиянии иАПФ в основном базировали на данных исследования MICRO-HOPE [47], но это исследование не включало истинную нефропатию (как в исследованиях RENAAL и IDTNT), которая была критерием исключения. Поэтому нельзя говорить о влиянии на прогноз при нефоропатии иАПФ. Безусловно, необходимы дальнейшие исследования.
В мае 2005 года публикуется письмо профессора J. McMurray, который был одним из участников организации исследования VALUE [44]. В этом письмеJ. McMurray называет данные, представленные S. Verma и M. Strauss, «неполными, неточными и неправильно проанализированными». В анализ не были включены результаты исследований OPTIMAL [48] и VALIANT [15], в которых проводилось прямое сравнение эффективности БРА (лозартана и валсартана соответственно) и иАПФ (каптоприла) у больных с острым ИМ и дисфункцией левого желудочка или СН. В этих исследованиях не отмечалось достоверной разницы между группами сравнения во влиянии на частоту развития ИМ. В исследовании RENAAL частота возникновения ИМ была статистически недостоверной, но существенно ниже (на 26 %), чем в группе сравнения. Кроме того, данное испытание не было спланировано как исследование определения кардиоваскулярных событий (иначе следовало изменить хотя бы число участников). И безусловно, нужно учитывать, что активная терапия, с которой сравнивают БРА, может снижать частоту развития ИМ.
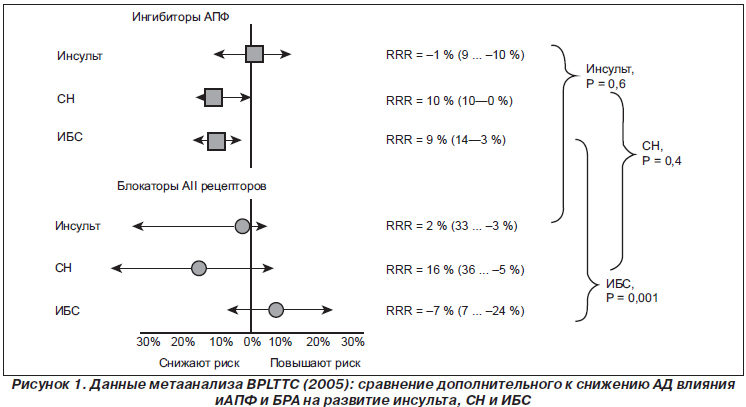
На XV конгрессе Европейского общества гипертензии в Милане (июнь 2005) докладывали о результатах одного из самых крупных метаанализов, который регулярно проводится экспертами нескольких клинических групп, — The Blood Pressure Lowering Treatment Trialists’ Collaboration (BPLTTC) [59]. Данные этого метаанализа опираются на результаты большого количества исследований и в дальнейшем используются для написания клинических руководств по лечению АГ. На конгрессе докладывали о результатах сравнения эффективности иАПФ и БРА. В этом анализе был сделан акцент на том, чтобы определить, имеют ли эти препараты дополнительное влияние на частоту развития конечных точек, которое не зависит от их способности снижать АД. В данном метаанализе было проанализировано 29 исследований с участием 160 тыс. пациентов и развитием 17 тыс. событий. Согласно конечным данным, иАПФ не обладают дополнительным к снижению АД достоверным влиянием на частоту развития инсульта 1 % (95% доверительный интервал –9—12 %) и частоту возникновения СН –10 % (95% доверительный интервал –10—0 %), но имеют дополнительное свойство достоверно снижать риск ИБС на 9 % (95% доверительный интервал –14 ... –3 %). Это значит, что положительное влияние иАПФ на частоту развития инсульта и СН связано с их способностью снижать АД, а способность снижать частоту развития ИБС связана и со снижением АД и с дополнительными, не зависящими от снижения АД, эффектами иАПФ. БРА, кроме их влияния, связанного со снижением АД, не обладали достоверным дополнительным положительным влиянием ни на частоту развития инсульта –2 % (95% доверительный интервал –32—3 %), ни на частоту развития ИБС 7 % (95% доверительный интервал –7—24 %), ни на частоту развития СН –16 % (–36—5 %). Это означает, что положительное влияние данной группы препаратов на частоту развития указанных событий связано исключительно со снижением АД. При сравнении двух групп препаратов, иАПФ и БРА, не было обнаружено достоверной разницы в их влиянии на возникновение инсульта и СН (рис. 1). Однако отмечались достоверные различия по их специфическому, независимому влиянию на частоту развития ИБС (р = 0,001), что означает, что иАПФ, в отличие от БРА, обладают специфическими защитными преимуществами в предупреждении коронарных событий. В дальнейшем эти данные подтвердились при проведении очередного метаанализа в 2007 году [7].
Данный метаанализ обладал следующими недостатками. Группы сравнения сильно различались по количеству (104 933 пациента в группе иАПФ и 32 603 в группе БРА), что могло влиять на статистические расчеты; целью данного метаанализа была только оценка дополнительных эффектов двух групп антигипертензивных препаратов, а не вообще их влияния на частоту развития событий; к моменту проведения анализа не существовало масштабных исследований, в которых сравнивалась бы эффективность БРА и иАПФ; в данном метаанализе не проводилось прямого сравнения влияния иАПФ и БРА на частоту развития ИМ, что не дает ответа на вопрос, повышают или нет БРА частоту развития ИМ по сравнению с иАПФ.
Сделанные самими исследователями выводы были следующими. В реальной жизни различия между антигипертензивными препаратами очень незначительны и их наличие уступает по своей значимости самому снижению АД. Комбинированная терапия АГ, включающая иАПФ, могла бы иметь преимущества. Терапия же БРА, по словам профессора S. Kjeldsen (президента Европейского общества гипертензии в момент подготовки метаанализа), является безопасной, обладает исключительно хорошей переносимостью, органопротекторными свойствами и предупреждает развитие неблагоприятных событий. Эти препараты особенно эффективны при СН и обладают способностью снижать частоту новых случаев развития сахарного диабета.
В поддержку БРА в сентябре 2005 в журнале British Medical Journal появляются результаты метаанализа M. McDonald с соавторами, включавшего данные 19 исследований [42]. Анализировалось влияние БРА на частоту развития ИМ по сравнению с плацебо и иАПФ. Оказалось, что не наблюдалось достоверного влияния БРА на развитие ИМ: по сравнению с плацебо OR = 0,94, р = 0,55, по сравнению с иАПФ OR = 1,01, P = 0,91. Авторы приходят к выводу, что, исходя из доступных на тот момент данных, то, что БРА увеличивают частоту развития ИМ, маловероятно, необходимы данные дополнительных исследований, в том числе ONTARGET/TRANSCEND.
Осенью 2005 г. в European Heart Journal были опубликованы метаанализ P. Verdecchia [74] с соавторами и комментарии к нему M. Strauss с соавторами [60]. Метаанализ включал данные лечения 31 958 пациентов, принимавших участие в 11 исследованиях. При этом проводилось сравнение БРА с иАПФ, плацебо и другими антигипертензивными препаратами. Данный метаанализ отличался высоким уровнем статистической обработки, при которой сравнение проводилось по двум различным моделям. Согласно его результатам, не было обнаружено достоверных различий во влиянии на развитие ИМ между БРА и иАПФ (OR = 0,99, НД), БРА и плацебо (OR = 0,96, НД), однако отмечалась почти достоверная разница по сравнению с другими антигипертензивными препаратами: OR = 1,16, р = 0,06 при использовании статистической модели random-effect и р = 0,017 при использовании модели fixed effect. По влиянию на частоту развития всех фатальных событий БРА достоверно не отличались от иАПФ (OR = 1,06, НД) и других антигипертензивных препаратов (OR = 0,99, НД). По сравнению с плацебо БРА достоверно снижали частоту развития фатальных событий (OR = 0,91, р = 0,042 при использовании обеих статистических моделей). При сравнении БРА с иАПФ + плацебо + другие антигипертензивные препараты не отмечалось достоверных различий по влиянию на частоту ИМ (OR = 1,03, НД) и фатальных событий (OR = 1,0, НД). Авторы приходят к выводу, что проведенный метаанализ не поддержал гипотезу о том, что БРА обладают каким-то вредным влиянием, и что необходимы результаты прямых сравнительных проспективных рандомизированных исследований для ответа на вопрос, повышают ли БРА вероятность развития ИМ.
Комментарии к этой статье были написаны совместно канадскими учеными — профессорами M. Strauss, E. Lonn, S. Verma [60]. Данные комментарии начинаются с оценки результатов BPLTTC (2005). Авторы указывают, что в этом анализе продемонстрировано преимущество иАПФ в предупреждении возникновения коронарных событий пред БРА и подчеркивают: «Если один режим доказанно является хотя бы немного более эффективным, чем другой, то выбор этого режима каждый год может предотвращать тысячи кардиоваскулярых событий». В метаанализе P. Verdecchia с соавторами, по их мнению, показано, что БРА в целом не оказывают отрицательного влияния на развитие ИМ. При этом, если сравнивать БРА отдельно с другими антигипертензивными препаратами, то они несколько увеличивают частоту ИМ. Это никак не может быть объяснено тем, что препараты сравнения обладают способностью снижать вероятность развития ИМ, ведь, как известно, ни атенолол, ни амлодипин не доказали, несмотря на снижение АД, свою эффективность в предупреждении ИМ.
Авторы комментариев также считают, что в мета-анализ нельзя включать неоднородные исследования. В испытаниях CHARM-Added и Val-HEFT 100 % и 93 % пациентов соответственно перед включением принимали иАПФ. В исследовании VALIANT 39 % получали иАПФ, которые фактически отменялись в среднем только на 5 дней (после развития ИМ), когда происходила рандомизация. При этом наибольшая разница в смертности наблюдалась именно на первой неделе ИМ, когда еще могло сохраняться последействие иАПФ. В дальнейшем показатели смертности на каптоприле и валсартане не различались. Поэтому в настоящее время остается неизвестным, одинаково ли иАПФ и БРА влияют на смертность у постинфарктных больных, которые до этого не получали блокаторов РАС. В исследовании OPTIMAL, в котором проводилось сравнение лозартана и каптоприла у больных с СН после ИМ, не наблюдалось различий по влиянию на частоту ИМ, однако у принимавших каптоприл отмечалось достоверно большее снижение кардиоваскулярной смерти. Но в исследовании ОРТIMAL все включенные в него пациенты были «наивными», то есть прежде не получали иАПФ. Возможно, поэтому, заключают авторы, результаты OPTIMAL отличались от результатов VALIANT. Однако в любом случае необходимо учитывать, что оба исследования были построены по принципу «non-inferiority», что означает «одна терапия незначимо хуже, чем другая». То есть маловероятно, что валсартан хуже, чем каптоприл, но он не соответствует каптоприлу по своей эффективности.
M. Staruss с соавторами также коснулись вопросов влияния снижения АД на частоту развития ИМ. Согласно предыдущим данным [30, 75], снижение САД на 10 мм рт.ст. ассоциируется со снижением риска ИМ на 15 %. ИАПФ, согласно анализy BPLTTC, обладают дополнительным положительным действием на возникновение ИМ, которое наблюдается помимо снижения АД [30]. БРА обладают способностью снижать АД, но не влияют на частоту развития ИМ (исследования CHARM-Alternative, CHARM-Preserved, IDNT). Кроме того, авторы коснулись некоторых экспериментальных данных, свидетельствующих, что длительная стимуляция рецепторов ангиотензина II 2-го типа может оказывать отрицательное терапевтическое действие [3]. Поэтому, по мнению авторов комментариев, иАПФ необходимо назначать всем пациентам с ИБС с СН или дисфункцией левого желудочка и без таковых и/или с сахарным диабетом. БРА могут быть альтернативой при СН, АГ и сахарном диабете тогда, когда существует непереносимость иАПФ, или могут добавляться к иАПФ при СН. Нет доказательств эффективности БРА у пациентов со стабильной ИБС без СН. В дальнейшем требуются результаты прямых сравнений в клинических испытаниях (прежде всего исследования ONTARGET/TRANSCEND) и больших (популяционных) исследованиях.
Фактически данные комментарии основываются на принципе: нет прямых доказательств, что БРА увеличивают частоту развития ИМ, однако при положительном влиянии на АД они эту частоту не снижают. При этом авторы забывают, что сами говорили об атенололе и амлодипине как о препаратах, которые снижают АД, но не влияют на вероятность развития ИМ. То есть не все антигипертензивные препараты обладают действием, направленным на предупреждение развития поражения коронарных артерий.
В 2005 году также выходят результаты метаанализа M. Volpe с соавторами, в котором не было установлено, что БРА повышают риск развития ИМ [79].
В январе 2006 года в журнале Journal of Human Hypertension публикуется очередной метаанализ B. Cheung с соавторами, который включал данные трех исследований — LIFE, SCOPE и VALUE [12]. Согласно его данным, БРА недостоверно снижали частоту развития смерти от всех причин (RRR = 0,96, 95% CI 0,88–1,06, р = 0,45), достоверно увеличивали вероятность развития ИМ (RRR = 1,12, 95% CI 1,01–1,26, P = 0,041) и очень значимо уменьшали вероятность развития сахарного диабета (RRR = 0,80, 95% CI 0,74–0,86, р < 0,0000001). Авторы делают вывод, что «снижение вероятности развития сахарного диабета может частично перевешивать увеличение частоты развития ИМ. Большинство пациентов с АГ требуют лечения более чем одним классом антигипертензивных препаратов. Небольшие различия в лечении не должны преобладать над важностью контроля АД».
Самая интересная полемика по вопросу влияния БРА на частоту развития ИМ и другие конечные точки развернулась на страницах журнала Circulation в августе 2006 года, когда под рубрикой «Контроверсии в кардиоваскулярной медицине» было опубликовано два обзора (оба — группами исследователей из Канады), включавшие данные собственных метаанализов. В одном обзоре приводились данные, свидетельствующие о негативном влиянии БРА, в другом — против такового. При этом проводился отдельный анализ исследований, в которых участвовали пациенты с определенной патологией (АГ, СН, ИМ, заболевания почек). В конце каждой статьи приводились комментарии оппонентов.
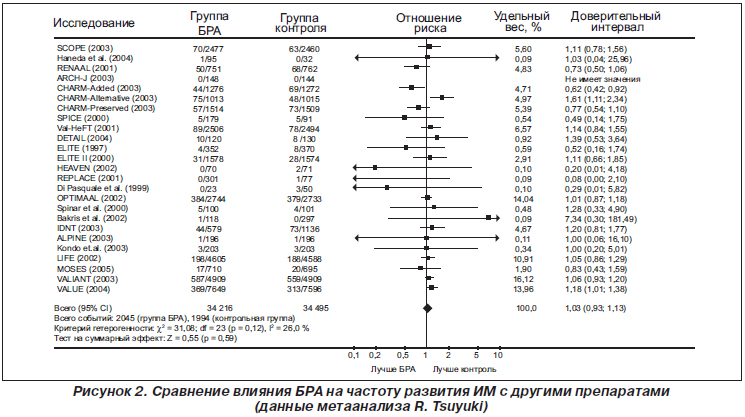
R. Tsuyuki с соавторами утверждали, что в исследовании VALUE увеличение риска развития ИМ на фоне терапии валсартаном по сравнению с амлодипином связано с разницей в достижении АД [71]. Анализ BPLTTC не дает никакой негативной информации о БРА. Он показывает только то, что эффективность БРА зависит от их способности снижать АД и что они не имеют дополнительного действия, в том числе и на развитие ИМ. Безусловным ограничением данного анализа было небольшое число пациентов, участвовавших в исследованиях с БРА. Авторы отмечают, что необходимы дополнительные исследования. При сахарном диабете БРА показали положительное влияние на функцию почек и отсутствие достоверного увеличения частоты развития ИМ. Метаанализ Stippoli с соавторами (см. выше) был проведен некорректно, так как исследования с участием иАПФ включали в основном пациентов с сахарным диабетом 1-го типа, которые по прогнозу значимо отличаются от пациентов с сахарным диабетом 2-го типа. В исследовании DETAIL не было обнаружено достоверных различий в частоте возникновения ИМ между телмисартаном и эналаприлом (OR = 1,36, НД). В дальнейшем потребуются дополнительные исследования именно у пациентов с сахарным диабетом. При СН отмечалось снижение смертности от всех причин и количества госпитализаций по поводу СН по сравнению с плацебо и не было обнаружено достоверных различий по сравнению с иАПФ. Результаты собственного метаанализа показали, что БРА не увеличивали риск развития ИМ у больных с СН [71]. В исследовании VALIANT не отмечалось достоверных различий между валсаратном и каптоприлом в частоте развития ИМ и смерти (OR = 1,0, НД) у пациентов высокого риска с дисфункцией левого желудочка/СН после ИМ. Назначение кандесартана в исследовании CHARM способствовало достоверному снижению риска кардиоваскулярной смерти/нефатального ИМ по сравнению с плацебо (OR = 0,87). Если бы БРА оказывали повреждающее воздействие, то это бы наблюдалось у различных категорий пациентов независимо от риска и предыдущей терапии. Поэтому возможно проведение метаанализа различных исследований для получения общей картины. Авторы провели такой метаанализ. Основные результаты представлены на рис. 2. Он включал 25 исследований, 68 711 пациентов, более 4000 случаев ИМ. Как видно из рис. 2, общий риск развития ИМ на фоне БРА составил 1,03 (р = НД). Исходя из этого, R. Tsuyuki с соавторами заключают, что БРА являются «безопасной эффективной альтернативой иАПФ у пациентов высокого риска». «Мы не адвокаты превосходства БРА над иАПФ, мы только утверждаем, что они не повышают риск развития ИМ; иАПФ остаются препаратами выбора для снижения риска ИМ».
Статья оппонентов, M. Strauss и A. Hall, начинается с цитаты Коперника: «Знание того, что мы знаем то, что мы знаем, и знание того, что мы не знаем то, что мы не знаем, и есть истинные знания» [59]. В ней выдвигается концепция «БРА парадокса», которая заключается в том, что нет доказательств того, что БРА повышают риск развития ИМ, но нет и доказательств того, что они снижают риск развития ИМ. Авторы тщательно анализируют данные экспериментальных исследований и приходят к выводу, что наряду с положительными эффектами существуют предположения о возможных негативных последствиях длительной стимуляции ангиотензиновых рецепторов 2-го типа, что может влиять на клиническое течение заболевания.
По их мнению, иАПФ имеют прямые доказательства эффективности у больных с ИБС — исследования EUROPA, HOPE, PEACE [22, 24, 84] и их суммарный анализ [25]. Их влияние на частоту развития кардиоваскулярных событий не ограничивается лишь снижением АД. Добавление иАПФ сопровождается дополнительным (на 9–12 %) снижением риска ИМ [7, 30]. В то же время во многих исследованиях БРА снижали АД, но не влияли на частоту развития ИМ или увеличивали ее. Так, в исследовании LIFE лозартан снижал пульсовое АД на 1,7 мм рт.ст. больше, чем атенолол, а частота развития ИМ была на 5 % выше в группе лозартана. В исследовании SCOPE кандесартан снижал САД/ДАД на 3,2/1,6 мм рт.ст. больше, чем плацебо, однако частота развития ИМ была недостоверно выше на 10 %. В исследовании VALUE влияние на частоту развития ИМ достигло статистически достоверных различий в 19 % в пользу амлодипина по сравнению с валсар-таном. При этом наблюдалась также разница в снижении АД в пользу амлодипина — 1,8/1,5 мм рт.ст. Этой разницей АД многие и объясняли более выраженное снижение частоты ИМ при применении амлодипина. Но, утверждают авторы, согласно первоначальной гипотезе исследования VALUE, ожидаемое OR для ИМ должно было составлять 0,98 при наличии градиента САД в 2,2 мм рт.ст. В реальном же исследовании OR составило 1,19. Поэтому различное влияние амлодипина и валсартана на частоту развития ИМ не может быть объяснено разницей в уровне АД.
В исследованиях ELITE (Evaluation of Losartan In The Elderly) [53] и Val-HEFT (Valsartan-Heart Failure Trial) было показано положительное влияние БРА на смертность у больных с СН, однако эти исследования были малочисленными. В пилотном исследовании RESOLVD (Radomized Evaluation of Strategies fоr Left Ventricular Dysfunction) кандесартан 16 мг по первичным конечным точкам не отличался от эналаприла 20 мг [43]. Однако это исследование было досрочно прекращено из-за большей смертности и частоты госпитализаций по поводу СН на кандесартане. В исследовании ELITE-II [52] не было статистически достоверных отличий по влиянию на конечные точки между лозартаном и каптоприлом, то есть положительные результаты исследования ELITE не подтвердились. Данное испытание, а также исследования OPTIMAAL (Optimal Trial In Myocardial infarction with the Angiotensin II Antagonist Losartan) и VALIANT (VALsartan In Acute myocardial iNfarcTion), в которых БРА сравнивались с каптоприлом, имели среднюю продолжительность 2,5 года, в то время как в исследовании SAVE (Survival And Ventricular Enlargement) разница в эффективности в пользу каптоприла по сравнению с плацебо появилась на этапе 3,5 года. То есть если бы исследования продолжались более длительный период, то, возможно, результаты были бы в пользу каптоприла (препарата первого поколения иАПФ). Авторы данного обзора снова касались особенностей лечения пациентов в исследовании CHARM. Они считают, что в ветках этого исследования CHARM-Added и CHARM-Preserved значительную роль сыграла предшествующая и совместная терапия иАПФ. А в ветке CHARM-Alternative кандесартан по сравнению с плацебо достоверно увеличивал частоту развития ИМ на 36 %, несмотря на снижение АД. Это, по мнению авторов, является свидетельством того, что по влиянию на смертность и частоту развития ИМ БРА у больных с СН можно сравнить с плацебо.
M. Strauss с соавтором также подробно касаются лечения больных после ИМ, с диастолической дисфунцией левого желудочка, сахарным диабетом и почечной недостаточностью. С их точки зрения, во всех существовавших на тот момент исследованиях с БРА нет однозначных прямых доказательств их эффективности: либо они увеличивали частоту возникновения ИМ, либо не влияли на смертность. При этом для иАПФ таких доказательств не существует. Авторы критикуют метаанализы в пользу БРА и приводят данные собственного метаанализа, согласно которым не было обнаружено достоверной разницы между иАПФ и БРА в частоте развития смерти от всех причин, кардиоваскулярной смерти, некардиоваскулярной смерти, инсульта и ИМ. При сравнении БРА с плацебо также не отмечалось достоверных отличий, за исключением некоторой тенденции к снижению частоты развития инсульта (OR = 0,84, р = 0,09). При сравнении БРА с плацебо/не иАПФ отмечалось достоверное увеличение частоты развития ИМ на БРА (OR = 1,13, р = 0,02), которое сохранялось при сравнении с плацебо/не иАПФ/иАПФ (OR = 1,08, р = 0,03). Фактически в 9 из 11 исследований, результаты которых были доступны на момент написания статьи, отмечалось увеличение частоты развития ИМ (в двух оно было достоверным). Когда же авторы провели такой же метаанализ, но при этом сравнивали иАПФ с плацебо, плацебо/не иАПФ, плацебо/не иАПФ/БРА, то оказалось, что результаты по влиянию на смертность, кардиоваскулярную смертность, инсульт (по сравнению с плацебо) и ИМ были высокодостоверными в пользу иАПФ. Из этого авторы делают следующий вывод: зачем назначать дорогостоящие БРА, если эффективность иАПФ значительно выше? Авторы приходят к заключению, что иАПФ должны быть препаратами выбора у пациентов высокого риска. В дальнейшем необходимо дождаться результатов исследований ONTARGET/TRANSCEND.
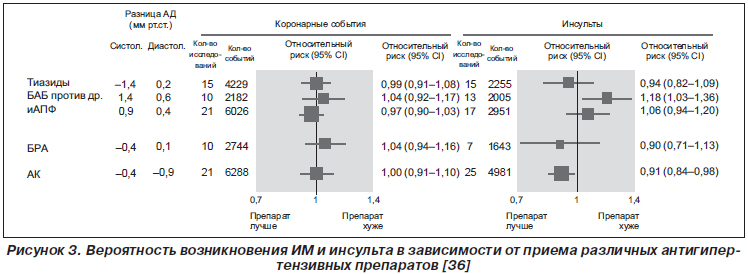
Этой точки зрения придерживаются и американские авторы, которые в 2009 году опубликовали свой новый метаанализ [46]. В ответ M.R. Law с соавторами высказали возражение: по результатам их метаанализа (рис. 3), частота ИМ не снижается не только на БРА по сравнению с лечением другими препаратами, но и на иАПФ дополнительного эффекта, кроме снижения АД, не наблюдается [36]. При этом частота возникновения инсульта снижалась на фоне БРА и антагонистов кальция. Похожие результаты были получены и в метаанализе G. Reboldi с соавторами [55]. Особенностью данного исследования явилось то, что в него включались данные только тех наблюдений, в которых БРА сравнивали или с иАПФ, или с комбинацией иАПФ + БРА. Оказалось, что никакой достоверной разницы по влиянию на риск возникновения ИМ между БРА и иАПФ нет, а по влиянию на риск инсульта БРА опять-таки имели преимущество.
На конгрессе Американского общества гипертензии 7 мая 2009 года были представлены результаты мета-анализа W. Elliott и S. Basu (американского), в который были включены данные обследования 276 396 пациентов с АГ [19]. Полученный риск развития осложнений, связанных с ИБС, на фоне приема различных препаратов по сравнению с диуретиками представлен в табл. 1.
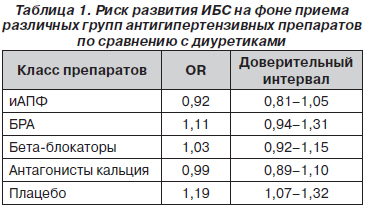
Как видно из табл. 1, лишь на фоне приема плацебо наблюдалось достоверное увеличение частоты развития ИБС по сравнению с диуретиками. Другие классы антигипертензивных препаратов достоверно не отличались по своему влиянию на риск развития ИБС от диуретиков. БРА были единственными препаратами, которые достоверно не отличались от плацебо по своему влиянию на частоту возникновения ИБС. Все другие классы препаратов достоверно снижали этот риск по сравнению с плацебо. То есть в этом метаанализе не было получено данных, указывающих на достоверное отрицательное влияние БРА на развитие коронарных событий. Однако не было получено и данных об их положительном влиянии.
В мае 2009 г. также были опубликованы результаты другого (европейского) метаанализа, в котором Massimo Volpe с соавторами сравнили влияние БРА (n = 53208) и других антигипертензивных препаратов (n = 53153) на частоту развития ИМ [80]. Оказалось, что достоверных различий нет: OR = 1,008 (CI 0,95–1,069). При анализе в зависимости от клинического состояния (АГ, СН, заболевания почек, ИБС, сахарный диабет) также не наблюдалось различий между БРА и другими антигипертензивными препаратами. По отношению к плацебо риск развития ИМ на фоне приема БРА составил 0,94 (CI 0,841–1,060), по отношению к бета-блокаторам и диуретикам — 0,97 (СI 0,80–1,17), к антагонистам кальция — 1,112 (CI 0,971–1,272), к иАПФ — 1,008 (CI 0,926–1,099). Комбинация БРА + + иАПФ по сравнению с другими антигипертензивными препаратами также достоверно не увеличивала частоту развития ИМ: OR = 0,996 (CI 0,896–1,107).
В 2011 г. наконец была поставлена точка в спорах, повышают или не повышают сартаны риск возникновения ИМ. Группа американских исследователей, которые ранее сильно критиковали БРА [46], опубликовала масштабный метаанализ, который включил результаты обследования 147 020 пациентов. Были сделаны следующие выводы. По сравнению с контролем (плацебо/другая терапия) БРА снижали риск инсульта на 10 %, сердечной недостаточности — на 13 %, новых случаев СД — на 15 %; БРА не ассоциировались с повышением риска ИМ (OR 0,99, CI 0,92–1,07), смертью или стенокардией [6]. После этого валсартан, как препарат, изучавшийся у пациентов после ИМ, вошел в Европейские рекомендации по ведению пациентов с острым коронарным синдромом и подъемом сегмента ST (2012). Cогласно этим рекомендациям, его можно назначать данной категории пациентов в качестве альтернативы иАПФ при наличии сердечной недостаточности или систолической дисфункции [69].
Таким образом, представленные данные свидетельствуют, что дебаты по поводу влияния БРА на частоту развития ИМ были широкомасштабными и привели к появлению большого количества метаанализов. Метаанализ — это разновидность получения определенных заключений о наличии или отсутствии влияния какого-то фактора на частоту возникновения того или иного события. Происходит суммирование данных, полученных в различных исследованиях, и на основании большого числа пациентов и количества возникших событий делаются выводы. Это не прямое рандомизированное сравнение, которое было бы оптимальным для достоверных заключений, но которое трудно провести на большом количестве пациентов из-за необходимых материальных вложений. Однако это источник информации, на который мы можем ориентироваться при выборе тактики ведения и лечения и на основе которого могут планироваться прямые сравнительные исследования. Недостатком данного метода является то, что часто результат может зависеть от выборки исследований, включенных в метаанализ. То есть если включить в него больше исследований с положительным результатом для какого-то фактора, то получишь положительный результат в целом метаанализе. Или можно включить малочисленные исследования с различными результатами и одно большое исследование с отрицательным — в этом случае результат может быть отрицательным и определяется именно более масштабным исследованием. Существуют методики определения вклада каждого из исследований в общий результат при проведении метаанализа, поэтому всегда следует обращать внимание на те исследования, которые сделали наибольший вклад в общий результат. В метаанализе M. Strauss и A. Hall наиболее значимыми исследованиями были VALIANT, OPTIMAL, VALUE, LIFE. В метаанализе T. Tsuyuki с соавторами также самый большой вклад был сделан VALIANT, OPTIMAL, VALUE, LIFE. Однако в первом метаанализе их общий вклад составил 83,97 %, а во втором — лишь 55,03 %. То есть данные второго метаанализа были «разбавлены» другими исследованиями в большей степени и их достоверность была меньшей.
Получается, результаты метаанализа определяются количеством и качеством включенных исследований. Кроме того, следует учитывать, что в метаанализ, как правило, включаются различные категории пациентов, и даже при недостоверном тесте на гетерогенность между больными все равно существуют различия, чего не наблюдается при проведении рандомизированных исследований. Поэтому лишь при проведении рандомизированных масштабных исследований можно говорить о более или менее достоверном влиянии того или иного фактора у данной категории пациентов.
Примером не совсем корректного метаанализа, вызвавшего многочисленные споры, был метаанализ, опубликованный в 2012 году, который касался пациентов с высоким риском кардиоваскулярных осложнений [72]. Согласно его результатам, при назначении иАПФ наблюдалось достоверное снижение смертности от любых причин по сравнению с другими препаратами. В то же время назначение сартанов не сопровождалось достоверным снижением частоты общей смерти по сравнению с другими препаратами. Поэтому исследователи сделали вывод, что было бы лучше основывать лечение пациентов высокого риска на иАПФ. Когда стали подробно рассматривать, какие исследования были включены в данный метаанализ, то оказалось, что в анализ с иАПФ включались исследования, в которых основным препаратом был не иАПФ: ASCOT (базовый препарат амлодипин, монотерапия проводилась у трети пациентов), ADVANCE (базовой была комбинация диуретика и иАПФ, которая назначалась как стартовая), HYVET (базовым препаратом был диуретик). В тех же исследованиях, включенных в данный метаанализ, где действительно базовым препаратом был иАПФ, достоверного влияния на смертность обнаружено не было. Кроме того, исследования, которые были включены в анализ по БРА, сильно различались гетерогенностью патологии: исследования MOSES и PRoFESS — пациенты после перенесенного инсульта (подобное исследование PROGRESS, в котором базовым препаратом был как раз иАПФ и в котором не было отмечено разницы по смертности по сравнению с плацебо, не включалось в анализ с иАПФ); исследования RENAAL и IDNT — пациенты с диабетической макропротеинурией, первичными конечными точками были почечные события, а не выживаемость; исследование NAVIGATOR — пациенты с метаболическим синдромом.
Из сказанного выше следует, что метаанализ — это во многом субъективное исследование, которое не может считаться несомненным доказательством. После получения каких-либо результатов в метаанализе они должны быть проверены в рандомизированных исследованиях. Если этого не происходит, то это выглядит как ситуация, когда сказали «а», но не сказали «б». При этом для «проигравшего» препарата данные метаанализа как ложка дегтя в бочке с медом: вроде бы и не доказали, что он плохой, но впечатление о нем испортили.
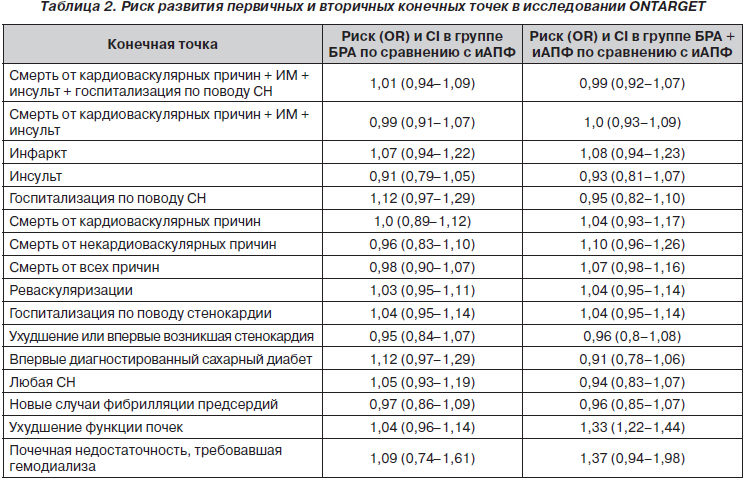
В настоящее время мы имеем несколько рандомизированных исследований, в которых проводилось сравнение иАПФ и БРА. Одним из них является исследование VALIANT, в которое включались пациенты с СН сразу после инфаркта миокарда. Не отмечено достоверных различий между каптоприлом и валсартаном во влиянии на смертность. Самым большим исследованием по сравнению иАПФ и БРА является ONTАRGET, опубликованное в апреле 2008 года [62]. В этом рандомизированном исследовании проводилось сравнение влияния БРА телмисартана, комбинации телмисартана с иАПФ рамиприлом и рамиприла на частоту развития неблагоприятных событий у пациентов высокого риска. Частота развития комбинированной конечной точки (смерть от кардиоваскулярных причин, инфаркт миокарда, инсульт или госпитализация по поводу СН) представлена на рис. 4.
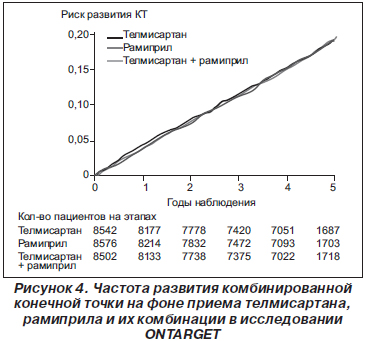
Как видно из рис. 4, БРА достоверно не отличались от иАПФ по влиянию на частоту развития комбинированной конечной точки. Не отмечалось и различий по влиянию на развитие отдельных конечных точек, в том числе и на ИМ (табл. 2). То есть телмисартан достоверно не увеличивал частоту развития ИМ у пациентов высокого риска старше 55 лет по сравнению с рамиприлом — препаратом, который в исследовании НОРЕ у такой же категории пациентов привел к достоверному снижению частоты развития ИМ на 19,5 %. Интересно, что в отличие от исследования VALIANT не отмечалось преимуществ комбинации БРА и иАПФ по сравнению с иАПФ в плане влияния на частоту развития ИМ. Не было отмечено различий и в воздействии на другие конечные точки. Более того, комбинация способствовала достоверному ухудшению функции почек. Получается, экспериментальные данные говорят о том, что совместное применение иАПФ и БРА — это очень хорошо, а клинические данные этого не подтверждают.
В сентябре 2008 года были опубликованы результаты исследования TRANSCEND [54, 70] (телмисартан против плацебо у пациентов высокого риска, которые не переносят иАПФ), в котором было показано, что риск развития ИМ был на 21 % меньше в группе пациентов, получавших телмисартан (р = 0,059), что сравнимо с данными исследования MOSES, в котором частота развития ИМ была недостоверно ниже на 17 % в группе пациентов, принимавших эпросартан, по сравнению с группой принимавших стандартную терапию [56]. При комбинированном анализе данных исследований TRANSCEND и PRoFESS также однозначно было показано снижение частоты развития комбинированной конечной точки (кардиоваскулярная смерть/ИМ/инсульт/госпитализация по поводу СН) в поздние сроки (более 6 месяцев лечения) на 14 % (р < 0,001). В мае 2009 г. в журнале «Vascular Health and Risk Management» D. Fitchett свою публикацию о результатах исследования TRANSCEND завершил словами: «В настоящее время было бы неразумно не рекомендовать БРА пациентам, которые не переносят иАПФ» [23].
В Японии было проведено исследование HIJ-CREATE (The Heart Institute of Japan Candesartan Randomized trial for Evaluation in Coronary Artery Disease) [34]. Это испытание было специально спланировано для больных с подтвержденной (коронарографией) ИБС и АГ, которые были рандомизированы получать БРА кандесартан или стандартную терапию без БРА (70 % из них получали иАПФ). Целевое АД составляло 130/85 мм рт.ст. Результаты данного исследования были следующими. Терапия на основе кандесартана по сравнению со стандартной терапией снижала (недостоверно) на 11 % частоту развития кардиоваскулярных событий (кардиоваскулярная смерть, нефатальный ИМ, нестабильная стенокардия, инсульт, другие кардиоваскулярные события, требовавшие госпитализации), на 63 % — частоту новых случаев сахарного диабета, имела меньше побочных эффектов и на 21 % (достоверно) уменьшала частоту развития кардиоваскулярных событий у пациентов со сниженной функцией почек.
Кроме рандомизированных исследований и мета-анализов существуют еще и популяционно-основанные и ретроспективные исследования. Первые — это исследования, полученные на основе ретроспективного анализа данных из административных источников. В них включаются все жители какой-либо популяции. В просто ретроспективный анализ включаются только пациенты, имеющие какой-либо признак (получающие терапию, поступившие в отделение, проходившие обследования). Эти исследования обычно характеризуются масштабностью и максимальным приближением к реальной практике.
В 2007 году были опубликованы данные двух больших наблюдений, в которых анализировалось влияние БРА на частоту развития коронарных событий. Одно из них, популяционный ретроспективный анализ, было проведено с участием S. Verma — того самого ученого, который в 2004 году начал дебаты по поводу отрицательного влияния БРА на риск ИМ [76]. В этом исследовании анализировалась частота возникновения острого коронарного синдрома (ИМ и нестабильная стенокардия) у пожилых пациентов города Онтарио (Канада) на фоне приема БРА и иАПФ. Были включены 1,4 млн человек в возрасте старше 65 лет, охваченных системой покрытия медицинских расходов. Каждый участник наблюдался 2 года. 49 037 пациентов принимали иАПФ, 16 456 — БРА. В целом было зарегистрировано 1295 случаев госпитализаций по поводу острого коронарного синдрома. Стандартизированный риск госпитализации по поводу острого коронарного синдрома для употреблявших БРА достоверно не отличался от употреблявших иАПФ и даже был на 11 % меньше (OR = 0,89, CI 0,76–1,04). При анализе в отдельных подгруппах пациентов (с атеросклерозом (OR = 0,85), сахарным диабетом (OR = 0,79), СН (OR = 0,84)) между иАПФ и БРА также не обнаружилось достоверных различий.
В ретроспективном исследовании T. Delea с соавторами сравнивались результаты лечения пациентов с АГ (n = 29357) без осложнений в анамнезе, которые принимали или лизиноприл (n = 17320), или валсартан (n = 6645), или метопролол медленного высвобождения (n = 5392) [16]. При регрессионном анализе Сох оказалось, что пациенты, принимавшие валсартан, имели достоверно меньший риск развития кардиоваскулярных и почечных событий (OR = 0,70, р = 0,0015), чем лица, принимавшие метопролол. По сравнению с лизиноприлом этот риск также был меньшим (OR = 0,89), однако недостоверно (р = 0,198).
Таким образом, в двух масштабных ретроспективных исследованиях было показано, что БРА не увеличивают, а снижают частоту развития кардиоваскулярных и почечных событий по сравнению с иАПФ.
Согласно действующим рекомендациям, при непереносимости иАПФ или при наличии противопоказаний к ним БРА могут быть достойной заменой у пациентов c ИБС и СН [33, 44, 63–69]. В отношении другой категории пациентов однозначных рекомендаций не существует. Так, в рекомендациях Европейского общества кардиологов 2007 г. по профилактике кардиоваскулярных заболеваний указывается, что БРА должны назначаться пациентам при невозможности назначить иАПФ [66]. А в рекомендациях этого же года Европейского общества гипертензии/Европейского общества кардиологов по лечению АГ нет указаний на первоочередное назначение иАПФ, а затем — при их непереносимости — БРА [64]. В этих рекомендациях лишь перечисляются показания к назначению данных групп препаратов. В последних Европейских рекомендациях БРА также остаются препаратами первого ряда для лечения АГ, особенно у пациентов с АГ и наличием гипертрофии левого желудочка, фибрилляции предсердий или с нефропатией и сахарным диабетом 2-го типа [68]. Благодаря своим нейропротекторным свойствам они также могут служить средствами для первичной и вторичной профилактики инсультов.
Есть ли разница в безопасности применения иАПФ и БРА?
БРА и иАПФ — это препараты, которые обычно хорошо переносятся пациентами. Однако во многих исследованиях было показано, что настойчивость (длительность приема от момента назначения) пациента в отношении приема антигипертензивных препаратов является наилучшей, если он получает монотерапию сартанами [8, 29, 41, 57, 82]. Так, по данным С. Bourgault с соавторами (рис. 5), через три года наблюдения на терапии вероятность того, что пациент останется на терапии БРА, была достоверно выше на 29 % по сравнению с иАПФ, на 42 % — по сравнению с антагонистами кальция, на 62 % — по сравнению с бета-блокаторами и на 92 % — по сравнению с диуретиками [8].
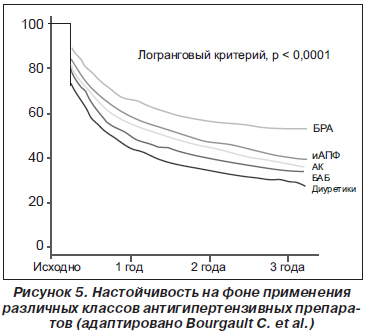
В исследовании W. Elliott с соавторами валсартан характеризовался наилучшей настойчивостью по сравнению с лизиноприлом, амлодипином и гидрохлортиазидом [20]. Согласно результатам других наблюдений пациенты, принимающие и иАПФ, и иБРА, имели одинаковую настойчивость и приверженность к лечению, однако переход на другую терапию по разным причинам (в том числе и из-за побочных эффектов) чаще происходил на фоне приема иАПФ — 24,2 против 13,1 % [73].
Известно, что в реальной практике частота осложнений выше, чем в рандомизированных исследованиях, ведь в рандомизированное исследование заведомо не включают пациентов, которые не переносят назначаемый препарат. Наиболее частой причиной перехода пациентов с иАПФ на другую терапию является появление кашля. В системном обзоре D. Matchar с соавторами показано, что частота возникновения кашля у пациентов на иАПФ в рандомизированных исследованиях составляет 9,9 %, а у пациентов на БРА в три раза меньше — 3,2 % [40]. В постмаркетинговых исследованиях говорится о том, что распространенность кашля у пациентов на иАПФ может достигать 20 % [18, 21, 78]. Особенно часто кашель встречается у женщин, афро-американцев и у лиц, которые имеют генотип АПФ II.
Еще одним грозным осложнением на фоне терапии иАПФ является появление ангионевротического отека. Этот побочный эффект может встречаться как на ранних, так и на поздних стадиях лечения иАПФ. Частота его возникновения низкая (0,1–0,3 %), но это состояние расценивается как потенциально угрожающий жизни побочный эффект иАПФ. Фактическая частота развития ангионевротического отека может быть выше из-за слабой и несвоевременной диагностики, при длительном применении в составе комбинированной терапии. Частота случаев возникновения отека может увеличиваться в определенных группах риска, например, среди афроамериканцев (в 3 раза), при совместном использовании с противодиабетическим препаратом ингибитором дипептидилпептидазы IV (в 4,57 раза) [11, 26], с цитостатиком ингибитором mTOR, который применяется у пациентов после трансплантации почки (6,6 %, 3,8 на 100 пролеченных лет). Долгое время ангионевротический отек считался осложнением терапии только иАПФ. Достоверных данных о том, что его вызывает именно сартан, а не другие совместно используемые вещества, не было, хотя аллергическая реакция на прием сартанов теоретически возможна и это указано в инструкции к препарату в разделе «Побочные явления». В исследовании ONTARGET было зарегистрировано появление ангионевротического отека на фоне рамиприла у 0,3 % пациентов, а на фоне телмисартана — у 0,1 % (р = 0,01) [62]. В исследовании LIFE частота ангионевротического отека составила 0,1 % у пациентов на лозартане и 0,2 % у пациентов на атенололе. В большинство рандомизированных исследований с использованием как иАПФ, так и БРА не включались пациенты, которые в анамнезе имели ангионевротический отек. Поэтому в реальной практике частота данного осложнения может быть выше, но на фоне БРА оно однозначно встречается реже, чем на фоне иАПФ.
В 2013 году были опубликованы данные о новом побочном эффекте, который может вызывать иАПФ, — зрительных галлюцинациях у пациентов пожилого возраста. Заметили это случайно, когда галлюцинации прошли после отмены иАПФ и возобновились после повторного (из-за повышения АД) назначения препарата [17]. При более детальном анализе базы данных банка побочных явлений в Англии оказалось, что имеется немало сообщений о галлюцинациях на фоне приема иАПФ, однако никто ранее с иАПФ их не связывал. Одним из возможных механизмов, через который опосредуется это побочное явление, является то, что иАПФ могут повышать уровень опиоидных пептидов. В дальнейшем планируется проведение более детального анализа этого побочного явления, и в скором времени, возможно, нам станет ясно, являются галлюцинации побочным эффектом иАПФ или нет.
В 2010 году много споров вызвала публикация в журнале Lancet Oncology данных метаанализа, согласно которым назначение БРА ассоциировалось с увеличением риска возникновения новых случаев раковых заболеваний (на 11 %, р = 0,001), но при этом смертность от опухолей достоверно не увеличивалась [58]. Последовало бурное обсуждение этих данных, в том числе среди пациентов началась паника: нужно или не нужно прекращать принимать сартаны? FDA было инициировано проведение дополнительного анализа и пересмотра сообщений о безопасности БРА. Результатом стало уведомление о том, что каких-либо достоверных данных о повышении риска возникновения опухолей на фоне БРА не обнаружено, однако ситуацию по этому вопросу FDA будет продолжать мониторировать. В 2011 году вышло дополнительное разъяснение для пациентов, что не нужно прекращать прием сартанов без консультации с врачом [31]. В том же году появляется новый метаанализ S. Connolly с соавторами, который включал уже 138 769 пациентов и в котором не было обнаружено достоверного увеличения ни случаев всех опухолей, ни случаев специфических опухолей на фоне приема БРА по сравнению с конт-ролем [13]. Это подтвердил и следующий метаанализ L. Azoulay с соавторами [5], в котором прием иАПФ и антагонистов кальция ассоциировался с увеличением риска рака легких (RR 1,13; 95% CI 1,06–1,20 и RR 1,19; 95% CI 1,12–1,27 соответственно).
Таким образом, история с влиянием БРА на частоту возникновения опухолей еще раз подтвердила условность данных метаанализов. Результаты подобных исследований должны быть проверены в рандомизированных проспективных наблюдениях. Кроме того, необходимо учитывать тот факт, что, как правило, пациенты, участвующие в рандомизированных исследованиях, находятся под тщательным наблюдением не только лечащих врачей, но и исследователей, что, возможно, обусловливает лучшую выявляемость опухолей. То, что даже в отрицательных метаанализах не увеличилась смертность от опухолей, подтверждает лучшую выявляемость, возможность лечения на ранних стадиях, низкую смертность.
Из вышеперечисленного следует, что БРА являются безопасными препаратами, имеющими лучшую переносимость, чем иАПФ. Они не уступают иАПФ по антигипертензивному и органопротекторному влиянию, а в ряде клинических ситуаций имеют преимущество. Они так же, как и иАПФ, предупреждают возникновение кардиоваскулярных событий и поэтому относятся к группе первого ряда в лечении АГ, то есть при наличии показаний мы можем начинать лечение пациента именно с БРА. При этом, даже если мы будем использовать их у пациентов, которые не переносят иАПФ, частота их назначения в Украине должна быть значительно выше, чем в настоящее время (5 %). Так, иАПФ назначаются 70 % пациентов. Непереносимость иАПФ имеют приблизительно 20 %. Значит, частота назначения БРА должна составлять около 15 %, но никак не 5 %. Малая доля, которая приходится на сартаны в нашей стране, означает, что часть пациентов вообще не получают блокаторы РАС, что не является правильным. Поэтому споры на тему «что лучше?» в Украине не имеют смысла. Они выглядят только как упражнения ученых умов в искусстве убеждения, основанном на создании проблемы из отсутствия доказательств.

1. Радченко А.Д. Нужны ли споры на тему: «Лучше сартаны или ингибиторы АПФ?» // Артериальная гипертензия. — 2014. — № 2. — С. 97-111.
2. 2013 ESH/ESC Guidelines for the management of arterial hypertension TheTask Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Journal of Hypertension. — 2013. — Vol. 31. — P. 1281-1357.
3. Akishita M., Horiuchi M., Yamada H. et al. Inflammation influences vascular remodeling through AT2 expression and signaling // Physiol. Genom. — 2000. — Vol. 2. — P. 13-20
4. ALLHAT Collaborative Research Group. Major outcomes in high-risk hypertensive patients randomized to angiotensin-converting enzyme inhibitor or calcium channel blocker vs diuretic. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) // J. Am. Med. Assoc. — 2002. — Vol. 288. — P. 2981-2997.
5. Azoulay L., Assimes T.L., Yin H., Bartels D.B., Schiffrin E.L., Suissa S. Long-term use of angiotensin receptor blockers and the risk of cancer // PLoS One. — 2012. — Vol. 7 (12). — P.: e50893. doi: 10.1371/journal.pone.0050893. Epub 2012 Dec 12.
6. Bangalore S., Kumar S., Wetterslev J., Messerli F. Angiotensin receptor blockers and risk of myocardial infarction: meta-analyses and trial sequential analyses of 147 020 patients from randomised trials // BMJ. — 2011. — Vol. 342. — P. 22-34
7. Blood Pressure Lowering Treatment Trialist’ Collabaration. Blood pressure-dependent and independent effects of agents that inhibit the rennin-angiotensin system // J. Hypertens. — 2007. — Vol. 25. — P. 951-958.
8. Bourgault C., Senecal M, Brisson M. et al. Persistence and discontinuation patterns of antihypertensive therapy among newly treated patients: a population-based study // J. Hum. Hypertens. — 2005. — Vol. 19 (8). — P. 607-613.
9. Braunwald E., Domanski M.J., Fowler S.E. et al. Angiotensin-converting-enzyme inhibition in stable coronary artery disease // N. Engl. J. Med. — 2004. — Vol. 351. — P. 2058-2068.
10. Brenner B., Cooper M., de Zeeuw D. et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy // N. Engl. J. Med. — 2001. — Vol. 345. — P. 861-869
11. Brown N.J., Byiers S., Carr D. et al. Dipeptidyl peptidase-IV inhibitor use associated with increased risk of ACE inhibitor-associated angioedema // Hypertension. — 2009. — Vol. 54. — P. 516-523.
12. Cheung B., Cheung G., Lauder I. et al. Meta-analysis of large outcome trials of angiotensin receptor blockers in hypertension // J. Hum. Hypertens. — 2006. —Vol. 20. — P. 37-43.
13. Connolly S. et al. Effects of telmisartan, irbesartan, valsartan, candesartan and losartan on cancer in 15 trials enrolling 138769 individuals. The ARB Trialist Collaboration // J. Hypertens. — 2011. — Vol. 29 (4). — P. 623-635.
14. Dahlof B., Devereux R.B., Kjeldsen S.E. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 995-1003.
15. Dalby A., McMurray J. VALIANT trial results support use of valsartan in acute myocardial infarction // Cardiovasc. Journal of South Africa. — 2003. — e-publication 5 December 2 — P. 1-3 (www.cvjsa.co.za).
16. Delea T., Taneja C, Moynahan A. et al. Valsartan versus lisinopril or extended-release metoprolol in preventing cardiovascular and renal events in patients with hypertension // American Journal of Health-System Pharmacy. — 2007. — Vol. 64. — P. 1187-1196.
17. Doane J., Barry Stults B. Visual hallucinations related to angiotensin-converting enzyme inhibitor use: case reports and review". ACCF / AHA 2011 Expert Consensus Document on Hypertension in the Elderly // J. Clin. Hypertens. — 2013. — Vol. 15. — P. 230-233.
18. Dykewicz M. Cough and Angioedema From Angiotensin-Converting Enzyme Inhibitors: New Insights Into Mechanisms and Management // http://www.medscape.com/viewarticle/484537_2.
19. Elliott W., Basu S., Meyer P. Initial drugs for coronary heart disease prevention in hypertensive patients: network and Bayesian meta-analysis of clinical trial data // J. Clin. Hypertension. — 2009. — Vol. 11. — P. A7.
20. Elliott W., Plauschinat C., Skrepnek G., Gause D. Persistence, adherence, and risk of discontinuation associated with commonly prescribed antihypertensive drug monotherapies // L. Am Board Fam. Med. — 2007. — Vol. 20. — P. 72-80.
21. Elliott W.J. Higher incidence of discontinuation of angiotensin converting enzyme inhibitors due to cough in black subjects // Clin. Pharmacol. Ther. — 1996. — Vol. 60. — P. 582-588.
22. Fegan G., Ward D., Clarke L. et al. The HOPE study and diabetes: Heart Outcomes Prevention Evaluation // Lancet. — 2000. — Vol. 355. — P. 1182-1183.
23. Fitchett D. Results of the ONTARGET and TRANSCEND studies: an update and discussion // Vascular Health and Risk Management. — 2009. — Vol. 5. — P. 21-29.
24. Fox K.M. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo controlled, multicentre trial (the EUROPA study) // Lancet. — 2003. — Vol. 362. — P. 782-788.
25. Gibbons R.J., Abrams J., Chatterjee K. et al. Expert Consensus document on angiotensin converting enzyme inhibitors in cardiovascular disease [in Spanish] // Rev. Esp. Cardiol. — 2004. —Vol. 57. — 1213-1232.
26. Glander P., Diekmann F., Dragun D., Neumayer H.H., Budde K. Increased incidence of angioedema with ACE inhibitors in combination with mTOR inhibitors in kidney transplant recipients. // Clin. J. Am. So.c Nephrol. — 2010. — Vol. 5 (4). — P. 703-708.
27. Granger B.B., Swedberg K., Ekman I. et al. Adherence to candesartan and placebo and outcomes in chronic heart failure in the CHARM programme: double-blind, randomised, controlled clinical trial // Lancet. — 2005 — Vol. 366. — P. 2011.
28. Granger C.B., McMurray J.J., Yusuf S. et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial // Lancet. — 2003. — Vol. 362. — P. 772-776.
29. Hansson L. Why don’t you do as I tell you? Compliance and antihypertensive regimens // Int. J. Clin. Pract. — 2002. — Vol. 56 (3). — P. 191-196.
30. http//www.medscape.com/viewarticle/507293
31. http://www.fda.gov/Drugs/DrugSafety/ucm354856.htm
32. Julius S., Kjeldsen S.E., Weber M. et al. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial // Lancet. — 2004. — Vol. 363. — P. 2022-2031.
33. Kaiser Permanente Care Management Institute. Guildelines: Secondary prevention of coronary artery disease clinical practice guidelines. — Oakland (CA): Kaiser Permanente Care Management Institute, 2006. — 117 p.
34. Kasanuki H., Hagiwara N., Hosoda S. et al. Angiotensin II receptor blocker-based vs. Non-angiotensin II receptor blocker-based therapy in patients with angiographically documented coronary artery disease and hypertension: the Heart Institute of Japan Candesartan Randomized Trial for Evaluation in Coronary Artery Disease (HIJ-CREATE) // Eur. Heart J. — 2009. — Vol. 30. — P. 1203-1212.
35. Ker J., Rheeder P. The effect of angiotensin receptor blockers on myocardial infarction: what are we to believe? // Cardiovascular Journal of South Africa. — 2005. — Vol. 16, № 2. — P. 81.
36. Law M.R., Morris J.K., Wald N.J. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies // BMJ. — 2009. — Vol. 338. — P. 1665.
37. Lee V., Rhew D., Dylan M. et al. Meta-analysis: angiotensin A receptor blockers in chronic heart failure and high risk acute myocardial infarction // Ann. Intern Med. — 2004. — Vol. 141. — P. 693-704.
38. Lindholm L.H., Ibsen H., Dahlof B. et al. Cardiovascular morbidity and mortality in patients with diabetes in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 1004-1010.
39. Lithell H., Hansson L., Skoog I. et al. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double—blind intervention trial // J. Hypertens. — 2003. — Vol. 21. — P. 875-886.
40. Matchar D.B., McCrory D.C., Orlando L.A. et al. Systematic review: comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers for treating essential hypertension // Ann. Intern. Med. — 2008. — Vol. 148. — P. 16-29.
41. Mazzaglia G., Mantovani L., Sturkenboom M. et al. Patterns of persistence with antihypertensive medications in newly diagnosed hypertensive patients in Italy: a retrospective cohort study in primary care // J. Hypertens. — 2005. — Vol. 23 (11). — P. 2093-2100.
42. McDonald M., Simpson S., Ezekowitz J. et al. Angiotensin receptor blockers and risk of myocardial infarction: systematic review // BMJ. — 2005. — Vol. 331. — P. 873-879.
43. McKelvie R.S., Yusuf S., Pericak D. et al. the RESOLVD Pilot Study Investigators. Comparison of candesartan, enalapril, and their combination in congestive heart failure: randomized evaluation of strategies for left ventricular dysfunction (RESOLVD) pilot study // Circulation. — 1999. — Vol. 100. — P. 1056-1064.
44. McMurray J. Letter. Angiotensin receptor blockers and myocardial infarction. Analysis of evidence is incomplete and inaccurate // BMJ. — 2005. — Vol. 330. — P. 1269.
45. McMurray J.J., Ostergren J., Swedberg K. et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial // Lancet. — 2003. — Vol. 362. — P. 767-771.
46. Messerli F.H., Bangalore S., Ruschitzka F. Angiotensin receptor blockers: baseline therapy in hypertension? // Eur. Heart J. — 2009. — Vol. 30 (20). — P. 2427-30.
47. MICRO-HOPE Study. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and the MICRO-HOPE substudy // Lancet. — 2000. — Vol. 355. — P. 253-259.
48. Mшller J., Dahlstrцm U., Gшtzsche O. et al. Effects of losartan and captopril on left ventricular systolic and diastolic function after acute myocardial infarction: results of the Optimal Trial in Myocardial Infarction with Angiotensin II Antagonist Losartan (OPTIMAAL) echocardiographic substudy // Am. Heart J. — 2004. — Vol. 147. — P. 494-501.
49. Opie L. ARBs and mortality in myocardial Infarction // Cardiovascular Journal of South Africa. — 2005. — Vol. 16, № 2. — P. 84.
50. Parving H., Lehnert H., Brochner-Mortensen J. et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes // N. Engl. J. Med. — 2001. — Vol. 345. — P. 870-878.
51. Pfeffer M.A., Swedberg K., Granger C.B. Et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme // Lancet. — 2003. — Vol. 362. — P. 759-766.
52. Pitt B, Poole-Wilson PA, Segal R. et al.Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial: the Losartan Heart Failure Survival Study ELITE II // Lancet. — 2000. — Vol. 355. — P. 1582-1587.
53. Pitt B., Segal R., Martinez F.A. et al. Randomised trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly Study, ELITE) // Lancet. — 1997. — Vol. 349. — P. 747-752.
54. Rayner B. Comments. Telmisartan shown to reduce cardiovascular death, myocardial infarction and stroke in ACE-intolerant high-risk patients // Cardiovascular Journal of South Africa. — 2008, advance publication 10 September. — P. 1.
55. Reboldi G., Angeli F., Cavallini C. et al. Comparison between angiotensin-converting enzyme inhibitors and angiotensin receptor blockers on the risk of myocardial infarction, stroke and death: a meta-analysis // J. Hypertens. — 2008. — Vol. 26 (7). — P. 1282-1289.
56. Schrader J., Luders S., Kulschewski A. et al. Morbidity and Mortality аfter Stroke, Eprosartan Compared with Nitrendipine for Secondary Prevention: principal results of a prospective randomized controlled study (MOSES) // Stroke. — 2005. — Vol. 36. — P. 1218-1226.
57. Siiskonen S., Breekveldt-Postma N., Vincze G. Higher persistence with valsartan compared with enalapril in daily practice // Vasc. Health Risk Manag. — 2007. — Vol. 3 (6). — P. 1039-1044.
58. Sipahi I., Debanne S., Rowland D., Simon D. et al. Angiotensin-receptor blockade and risk of cancer: meta-analysis of randomised controlled trials // The Lancet Oncology. — 2010. — Vol. 11. — P. 627-636.
59. Strauss M., Hall A. Angiotensin Receptor Blockers May Increase Risk of Myocardial Infarction: Unraveling the ARB-MI Paradox // Circulation. — 2006. — Vol. 114. — P. 838-854.
60. Strauss M., Lonn E., Verma S. Is the jury out? Class specific differences on coronary outcomes with ACE-inhibitors and ARBs: insight from meta—analysis and The Blood Pressure Lowering Treatment Trialists’ Collaboration // European Heart Journal. — 2005. — Vol. 26. — P. 2351-2353.
61. Strippoli G.F., Craig M., Deeks J.J., Schena F.P., Craig J.C. Effects of angiotensin converting enzyme inhibitors and angiotensin II receptor antagonists on mortality and renal outcomes in diabetic nephropathy: systematic review // BMJ. — 2004. — Vol. 9, № 329. — P. 828.
62. The ONTARGET Investigators Telmisartan, Ramipril, or Both in Patients at High Risk for Vascular Events // N. Engl. J. Med. — 2008. — Vol. 358. — P. 1547-1559.
63. The Task force for management of stable angina pectoris of European Society of cardiology: full text // Eur. Heart J. — doi: 10.1093 / eurheartj / ehl002.
64. The Task Force for the Management of Arterial Hypertension of the ESH and ESC 2007 // J. Hypertens. — 2007. — Vol. 25. — P. 1105-1187.
65. The Task force members. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008 // Eur. Heart J. — 2008. — Vol. 29. — P. 2388-2442.
66. The Task force members. European guidelines on cardiovascular disease prevention in clinical practice: executive summary // Eur. Heart J. — 2007. — Vol. 28. — P. 2375-2414.
67. The Task force members. European guidelines. Management of acute myocardial infarction in patients with presenting persistent ST-segment elevation // Eur. Heart J. — 2008. — Vol. 29. — P. 2909-2945.
68. The Task force members. Guidelines in diabetes, prediabetes and cardiovascular disease: full text // Eur. Heart J. — doi: 10.1093/eurheartj/eht108
69. The Task Force on the management of ST—segment elevation acute myocardial infarction of the European Society of Cardiology (ESCESC Guildelines for the mangement of acute myocardial infarction in patients presenting with ST-segment elevation // Eur. Heart J. — 2012. — Vol. 33.— P. 2569-2619.
70. The Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease (TRANSCEND) Investigators Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial // The Lancet. — 2008. — Vol. 372. — P. 1174-1183.
71. Tsuyuki R., McDonald M. Angiotensin Receptor Blockers Do Not Increase Risk of myocardial Infarction // Circulation. — 2006. — Vol. 114. — P. 855-860.
72. vanVark L.C., Bertrand M., Akkerhuis K.M. еt al. Angiotensin-converting enzyme inhibitors reduce mortality in hypertension: a meta-analysis of randomized clinical trials of renin-angiotensin-aldosterone system inhibitors involving 158,998 patients // Eur. Heart J. — 2012. — Vol. 33 (16). — P. 2088-2097.
73. Vegter S., Nguyen N., Visser S. et al. Compliance, persistence, and switching patterns for ACE inhibitors and ARBs // Am. J. Manag. Care. — 2011. — Vol. 17 (9). — P. 609-616.
74. Verdecchia P., Angeli F., Gattobigio R., Reboldi G.P. Do angiotensin II receptor blockers increase the risk of myocardial infarction? // Eur. Heart J. — 2005. — Vol. 26. — P. 2381-2386.
75. Verdecchia P., Reboldi G., Angeli F. et al. Angiotensin-converting enzyme inhibitors and calcium channel blockers for coronary heart disease and stroke prevention // Hypertension. — 2005. — Vol. 46. — P. 386-392.
76. Verma S., Mamdani M., Al-Omran M. et al. Angiotensin receptor blockers vs. angiotensin converting enzyme inhibitors and acute coronary syndrome outcomes in elderly patients: a population-based cohort study (UMPIRE study results) // J. Am. Soc. Hypertens. — 2007. — Vol. 1. — P. 286-294.
77. Verma S., Strauss M. Angiotensin receptor blockers and myocardial infarction // BMJ. — 2004. — Vol. 329. — P. 1248-1249.
78. Visser L.E., Stricker B.H., van der Velden J. et al. Angiotensin converting enzyme inhibitor associated cough: a population-based case-control study // J. Clin. Epidemiol. — 1995. — Vol. 48. — P. 851-857.
79. Volpe M., Mancia G., Trimarco B. Angiotensin II receptor blockers and myocardial infarction: deeds and misdeeds // J. Hypertens. — 2005. — Vol. 23. — P. 2113-2118.
80. Volpe M., Tocci G., Sciarretta et al. Angiotensin II receptor blockers and myocardial infarction: an updated analysis of randomized clinical trials // J. Hypertens. — 2009. — Vol. 27. — P. 941-946.
81. Weber M.A., Julius S., Kjeldsen S.E. et al. Blood pressure dependent and independent effects of antihypertensive treatment on clinical events in the VALUE Trial // Lancet. — 2004. — Vol. 363. — P. 2049-2051.
82. Yiannakopoulou E.Ch1., Papadopulos J.S., Cokkinos D.V., Mountokalakis T.D. Adherence to antihypertensive treatment: a critical factor for blood pressure control // Eur. J. Cardiovasc. Prev. Rehabil. — 2005. — Vol. 12 (3). — P. 243-249.
83. Yusuf S., Pfeffer M.A., Swedberg K. et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial // Lancet. — 2003. — Vol. 362. — P. 777-781.
84. Yusuf S., Sleight P., Pogue J. et al. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients // N. Engl. J. Med. — 2000.