Вступ
Однією з найактуальніших проблем сьогодення залишаються надлишкова маса тіла й ожиріння. Згідно з визначенням асоціації ендокринологів, ожиріння — це хронічне рецидивуюче мультифакторне захворювання, що характеризується підвищеним відкладанням жиру та збільшенням маси тіла. До факторів, що визначають розвиток ожиріння, належать: генетичні, демографічні (вік, стать, етнічна приналежність), соціально-економічні, психологічні (перенапруження нервової системи), поведінкові (харчування, фізична активність, алкоголь, куріння, стреси) та нейроендокринні порушення [1].
Ожиріння належить до найбільш поширених хронічних захворювань у світі та сягає масштабів неінфекційної епідемії. За даними Всесвітньої організації охорони здоров’я, у 2014 році ожиріння зареєстровано в 13 % дорослого населення світу (11 % чоловіків і 15 % жінок). Загалом від ожиріння страждає близько 20,1 % населення нашої країни. За даними Міністерства охорони здоров’я України, серед чоловіків ожиріння відмічається в 15,9 % та серед жінок — у 25,7 % [19].
Жирова тканина — ендокринний орган, що виконує низку ендокринних, паракринних і автокринних функцій: активно секретує естрогени (ароматаза адипоцитів сприяє синтезу естрогенів із надниркових андрогенів), ангіотензиноген, простагландини, фактор некрозу пухлини α, інтерлейкін-6, лептин, резистин, адипонектин, інсуліноподібний фактор росту 1, інгібітор активатора плазміногену I [20]. Як ендокринний орган жирова тканина виділяє кілька циркулюючих факторів, що можуть або збільшувати і посилювати, або зменшувати масу трабекулярної кісткової тканини. Важливо відзначити, що вироблені жировою тканиною гормони й адипоцитокіни визначають тип взаємодії між кістковою та жировою тканинами. В останньому дослідженні за участю жінок у постменопаузі було відзначено, що відносно велика кількість вісцерального жиру і невелика — підшкірної жирової клітковини може мати шкідливий вплив на якість кісткової тканини. Надмірна кількість вісцерального жиру є морфологічним субстратом інсулінорезистентності та голов–ним критерієм метаболічного синдрому, самостійним чинником ризику розвитку багатьох тяжких захворювань, таких як цукровий діабет 2-го типу та атеросклероз. Крім цього, надлишкова маса тіла й ожиріння є фактором ризику розвитку ішемічної хвороби серця, гіпертонічної хвороби, ішемічного інсульту, раку ободової кишки, раку молочної залози, раку ендометрія й остеоартрозу, а також негативно впливає на психологічне здоров’я людей і якість їх життя. Чи не єдиним позитивним аспектом наявності ожиріння раніше вважався його протективний ефект щодо розвитку остеопорозу.
Ожиріння й остеопороз — два метаболічних захворювання, поширеність яких значно зросла останніми десятиліттями. Частково це може бути пов’язано з глобальним постарінням населення багатьох країн світу. Поєднання цих порушень, що раніше вважалися взаємовиключними, створює спектр проблем для клініцистів. Обидва захворювання мають генетичне підґрунтя, проте є чутливими до різноманітних факторів навколишнього середовища. Вони виявляються в молодому віці, та їх прогресування до повної клінічної картини може зайняти десятиліття. Ці два стани навіть окремо пов’язані з підвищенням захворюваності та смертності, а за умови їх поєднання в одного пацієнта багаторазово посилюють патологічний вплив.
Остеопороз (ОП) — найбільш поширене системне захворювання скелета, що характеризується зниженням кісткової маси й структурними змінами кісткової тканини, які виражені настільки, що навіть при незначній травмі можливе виникнення переломів. Проблема ОП на сьогодні також привертає увагу багатьох дослідників, оскільки, згідно з даними Всесвітньої організації охорони здоров’я, ОП входить до четвірки захворювань, що займають провідні позиції за показниками смертності та інвалідизації населення разом із серцево-судинними захворюваннями, цукровим діабетом і онкологічною патологією. Оскільки ОП перебігає без характерної клінічної картини аж до виникнення перелому, важливим напрямком у вивченні ОП є виявлення нових факторів ризику розвитку ОП і переломів. Визначення мінеральної щільності кісткової тканини (МЩКТ) за допомогою двофотонної рентгенівської абсорбціометрії (DXA) на рівні шийки стегнової кістки, поперекового відділу хребта й усього скелета є золотим стандартом для встановлення діагнозу «остеопороз» та моніторингу ефективності лікування. Відомо, що міцність кісткової тканини залежить від декількох параметрів: мікрогеометрії кортикального шару кістки, МЩКТ, мікроархітектури трабекулярної кістки, мікропошкоджень, мінералізації та метаболізму кісткової тканини.
Дослідження в дорослих і дітей виявили, що МЩКТ має позитивний зв’язок із масою тіла й індексом маси тіла (ІМТ), хоча є протиріччя щодо переважного впливу м’язової або жирової маси на МЩКТ. Епідеміологічні дослідження виявили, що надлишкова маса тіла та високий ІМТ корелюють із кращими показниками МЩКТ. За результатами численних лабораторних і клінічних досліджень відомо, що низька маса тіла або низький ІМТ у чоловіків і жінок є сильними предикторами низької МЩКТ та підвищеного ризику переломів, що враховується в алгоритмі FRAX, розробленому для розрахунку 10-річного ризику переломів. Але цей алгоритм працює лише для пацієнтів з ІМТ < 30 кг/м2, тоді як вплив маси тіла на ризик переломів у дорослого населення з ожирінням (ІМТ > 30 кг/м2) усе ще не визначено.
Декілька нещодавно проведених досліджень показують, що ожиріння захищає організм людини від переломів, і тоді ж стверджують, що ожиріння є фактором ризику для певних типів переломів. А саме дослідження Hsu, проведене на великій когорті китайських чоловіків і жінок, показує, що частота невертебральних переломів значно вища в пацієнтів із більш високим відсотком жирової тканини в організмі незалежно від маси тіла [22]. Високий ризик невертебральних переломів у людей з ожирінням може виникнути внаслідок змін кісткової мікроархітектури, зниження якості кісткової тканини або під впливом факторів, що пов’язані з міцністю кісток.
У перехресне дослідження M.R. Salamat та спів–авт. були включені 5892 чоловіки та жінки (183 чоловіки < 50 років, 409 чоловіків ≥ 50 років, 1832 жінки в пременопаузі та 3468 жінок у пост–менопаузі). Середній вік для чоловіків < 50 років становив 41,7 ± 8,3 року, для чоловіків ≥ 50 років — 64,5 ± 9,7, для жінок в пременопаузі — 44,1 ± 7,9 і жінок після менопаузи — 60,3 ± 8,3 року. Середній ІМТ для чоловіків < 50 років становив 25,9 ± 4,2 кг/м2, 26,5 ± 4,2 кг/м2 — для чоловіків ≥ 50 років, 28,6 ± 4,6 — для жінок у пременопаузі та 29,0 ± 4,6 — для жінок у постменопаузі. З даного дослідження були виключені пацієнти, які мали захворювання печінки, нирок, щитоподібної та прищитоподібних залоз, онкологічні захворювання; пацієнти, які приймали препарати для лікування остеопорозу; жінки, які приймали пероральні контрацептиви або замісну гормональну терапію; вагітні та жінки в період лактації. Установлено, що 82 (40,8 %) чоловіки < 50 років, 160 (41,0 %) чоловіків ≥ 50 років, 752 (41,2 %) жінки в пременопаузі, 1371 (39,6 %) жінка в постменопаузі мали надлишкову вагу і 36 (17,9 %) чоловіків < 50 років, 81 (20,8 %) чоловік ≥ 50 років, 632 (34,8 %) жінки в пременопаузі й 1447 (41,7 %) — у постменопаузі страждали від ожиріння. Усім пацієнтам проводилася DXA з метою вивчення МЩКТ на рівні поперекового відділу хребта та стегнової кістки, а також для оцінки будови тіла. При порівнянні чоловіків ≥ 50 років та жінок із нормальною вагою з поправкою на вік відносний ризик (ВР) остеопенії становив 0,19 (95% довірчий інтервал (ДІ) 0,07–0,56) і 0,38 (95% ДІ 0,29–0,51) для чоловіків з ожирінням ≥ 50 років і жінок після менопаузи відповідно, ВР остеопорозу становив 0,26 (95% ДІ 0,11–0,64) і 0,15 (95% ДІ від 0,11–0,20)
відповідно. У цьому дослідженні ожиріння значно знижує ризик розвитку остеопорозу, остеопенії та низької МЩКТ у всіх учасників. Не було виявлено жодного впливу статі та менопаузи на ожиріння, що є парадоксом при остеопорозі. Результати дослідження показали, що серед чоловіків ≥ 50 років спостерігалася більш висока поширеність остеопорозу, ніж серед жінок після настання менопаузи [21].
De Laet із колегами провели метааналіз даних та встановили, що ніякого додаткового збільшення ризику перелому стегна не було зареєстровано в чоловіків із більш високим ІМТ порівняно з чоловіками з нормальною масою тіла. Проте в дослідженні Osteoporotic Fracturesin Men, в якому обстежували чоловіків ≥ 65 років, ожиріння було пов’язано з більш високою частотою невертебральних переломів (гомілки та проксимального відділу плечової кістки) порівняно з чоловіками з нормальною масою тіла незалежно від МЩКТ. У цьому дослідженні більшість чоловіків (72 %) мали надлишкову масу тіла або страждали від ожиріння і менше 1 % мали недостатню масу тіла. Тому отримані результати узгоджуються з попередньо проведеними дослідженнями, в яких було доведено, що найвищий ризик перелому стегнової кістки в чоловіків зі зниженою масою тіла, але було припущено, що ожиріння може збільшувати ризик невертебральних переломів незалежно від МЩКТ [14].
У ретроспективному дослідженні іспанські вчені проаналізували дані 186 171 чоловіка віком ≥ 65 років, які проживали в Каталонії (північний схід Іспанії), з яких 139 419 (74,9 %) мали доступні виміри ІМТ. Обстежені чоловіки були розподілені на три групи згідно з ІМТ: зі зниженою/нормальною масою тіла (ІМТ < 25 кг/м2, n = 26 298), надлишковою масою тіла (≤ 25 ІМТ < 30 кг/м2, n = 70 851) та ожирінням (ІMТ ≥ 30 кг/м2, n = 42 270). Лише 0,6 % чоловіків (n = 806) мали недостатню масу тіла (ІМТ < 18,5 кг/м2). Було зафіксовано вірогідно менше випадків переломів хребта і стегнової кістки в чоловіків з ожирінням (ВР 0,65; 95% ДІ 0,53–0,80 і ВР 0,63; 95% ДІ 0,54–0,74 відповідно) та надлишковою масою тіла (ВР 0,77; 95% ДІ 0,64–0,92 і ВР 0,63; 95% ДІ 0,55–0,72 відповідно) порівняно з чоловіками зі зниженою/нормальною масою тіла. Крім того, чоловіки з ожирінням мали меншу кількість переломів зап’ястка/передпліччя (ВР 0,77; 95% ДІ 0,61–0,97) і кісток таза (ВР 0,44; 95% ДІ 0,28–0,70) порівняно з чоловіками зі зниженою/нормальною масою тіла. З іншого боку, множинні переломи ребер частіше зустрічалися в чоловіків із надлишковою масою тіла (ВР 3,42; 95% ДІ 1,03–11,37) та з ожирінням (ВР 3,96; 95% ДІ 1,16–13,52) [16]. Існує думка, що через обмежені фізичні можливості людина з ожирінням під час падіння, імовірно, впаде назад або убік, а не вперед, тим самим захищаючи зап’ясток від удару.
Незважаючи на численні підтвердження того, що жирова тканина має протективний вплив на скелет, число досліджень, що свідчать протилежне, збільшується. Вивчення взаємозв’язків між кістковою та жировою тканиною на молекулярному та клітинному рівнях може призвести до кращого розуміння механізмів розвитку остеопорозу й ожиріння та допоможе розробити тактику лікування цих захворювань.
Мета дослідження: оцінити показники мінеральної щільності та якості кісткової тканини в чоловіків з ожирінням.
Матеріали та методи
В Українському науково-медичному центрі проблем остеопорозу було обстежено 396 чоловіків віком 40–89 років. Чоловіки були розподілені на такі групи залежно від ІМТ: I — 129 чоловіків з ожирінням (ІМТ ≥ 30 кг/м2; середній вік — 59,9 ± 10,4 року, середній зріст — 174,4 ± 6,8 см, середня маса тіла — 100,0 ± 9,8 кг, середній ІМТ — 32,9 ± 2,6 кг/м2),
II — 267 чоловіків без ожиріння (ІМТ < 30 кг/м2; середній вік — 60,9 ± 12,5 року, середній зріст — 174,3 ± 6,7 см, середня маса тіла — 77,1 ± 9,8 кг, середній ІМТ — 25,3 ± 2,6 кг/м2). Пацієнти обох груп були додатково розподілені на підгрупи по десятиріччям.
У дослідження не включали чоловіків, які мали в анамнезі захворювання або приймають препарати, що мають доведений вплив на метаболізм кісткової тканини.
МЩКТ на рівні всього скелета, поперекового відділу хребта (L1–L4), шийки стегнової кістки та ультрадистального відділу кісток передпліччя досліджували методом двохенергетичної рентгенівської денситометрії (Prodigy, GE Lunar, Мадісон, США). Якість трабекулярної кісткової тканини (Trabecular Bone Score — TBS) на рівні поперекового відділу хребта (L1–L4) оцінювали за допомогою методики TBS iNight® (Med-Imaps, Pecass, Франція). Визначали антропометричні показники: зріст (см), масу тіла (кг), ІМТ вираховували за формулою: ІМТ = маса тіла, кг/зріст, м2.
Статистичний аналіз проводили за допомогою програми Statistica 10.0. Результати подані як середні величини (M ± SD). Різницю між групами встановлювали за допомогою однофакторного дисперсійного аналізу ANOVA. Міжгрупові відмінності оцінювали за допомогою тесту Шеффе. Взаємозв’язок жирової маси та МЩКТ, TBS (L1–L4) визначали, використовуючи лінійну регресію. Різницю показників вважали вірогідною при р < 0,05.
Результати
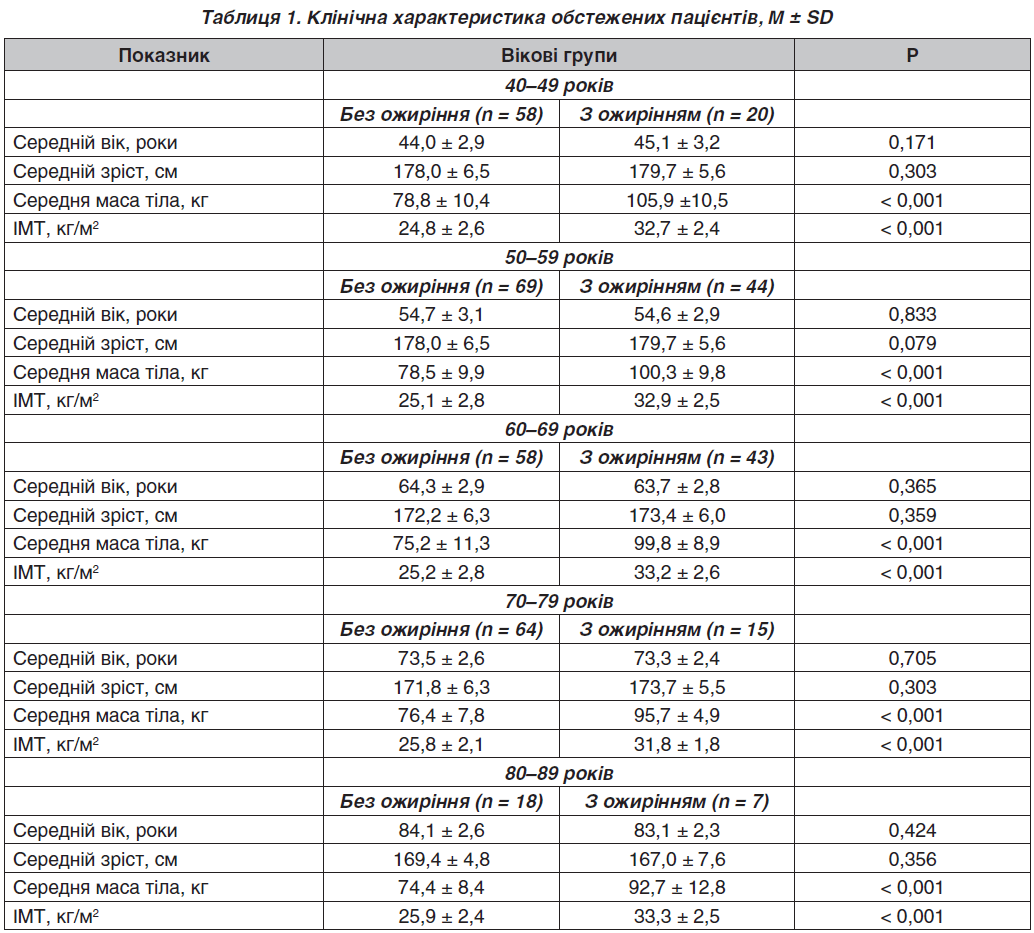
У загальній групі ми виявили, що чоловіки з ожирінням мають значно вищу МЩКТ порівняно з чоловіками без ожиріння на рівні поперекового відділу хребта (I група — 1,289 ± 0,212 г/см2, II група — 1,172 ± 0,237 г/см2; F = 22,59; р < 0,001), шийки стегнової кістки (I група — 0,964 ± 0,148 г/см2, II група — 0,914 ± 0,150 г/см2; F = 25,18; р < 0,001), усього скелета (I група — 1,277 ± 0,098 г/см2, II група — 1,185 ± 0,118 г/см2; F = 57,38; р < 0,001) і ультрадистального відділу кісток передпліччя (I група — 0,555 ± 0,086 г/см2, II група — 0,494 ± 0,095 г/см2; F = 37,57; р < 0,001) (рис. 1).
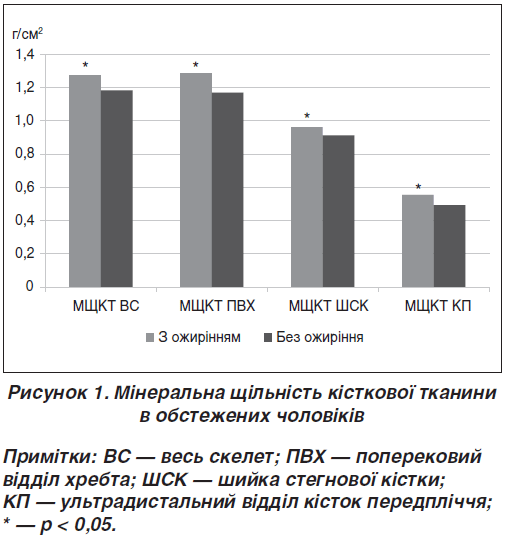
Показник TBS (L1–L4) вірогідно нижчий у чоловіків з ожирінням порівняно з чоловіками з нормальною масою тіла (I група — 1,053 ± 0,161, II група — 1,197 ± 0,167; F = 66,48; р < 0,001) (рис. 2).
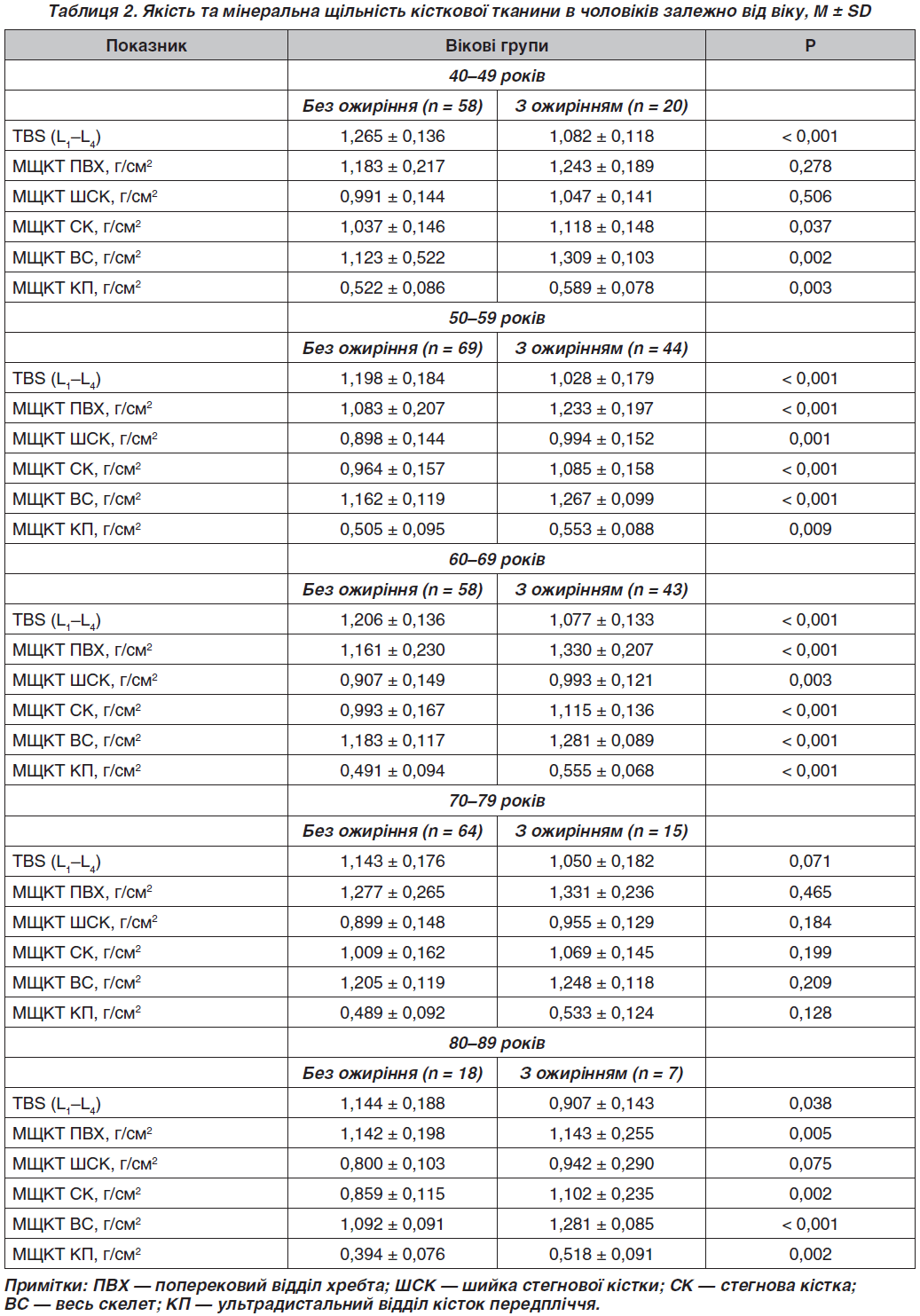
При оцінці будови тіла встановлено, що чоловіки з ожирінням порівняно з чоловіками з нормальною масою тіла мають вірогідно вищі показники жирової (I група — 34117,63 ± 5934,17, II група — 19654,96 ± 7037,20; F = 401,91; р < 0,001) та знежиреної маси усього тіла (I група — 62412,65 ± 6379,61, II група — 55206,82 ± 6282,80; F = 112,25; р < 0,001) (рис. 3).
При аналізі МЩКТ залежно від віку нами встановлено, що МЩКТ поперекового відділу хребта, шийки стегнової кістки і всього скелета знач–но відрізняються в чоловіків віком 40–49, 50–59, 60–69 і 80–89 років (р < 0,05). У той же час у чоловіків віком 70–79 років показники МЩКТ поперекового відділу хребта (р = 0,46), шийки стегнової кістки (р = 0,18), усього тіла (р = 0,21), ультрадистального відділу кісток передпліччя (р = 0,13) і TBS (р = 0,07) істотно не відрізнялися (табл. 2).
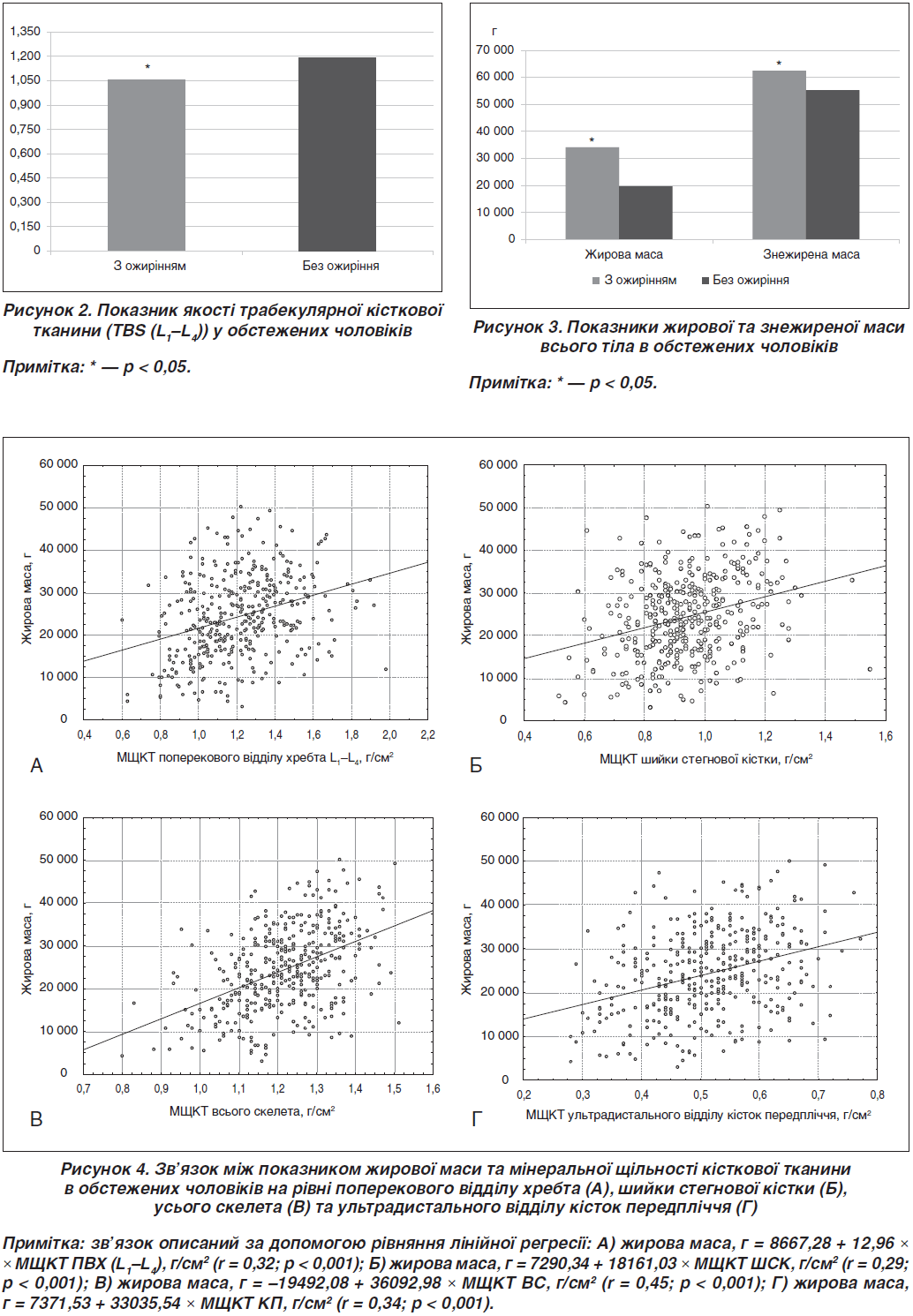
Було проведено регресійний аналіз та встановлено позитивний вірогідний зв’язок між показником жирової маси та МЩКТ на рівні всього скелета, поперекового відділу хребта (L1–L4), шийки стегнової кістки та ультрадистального відділу кісток передпліччя (рис. 4).
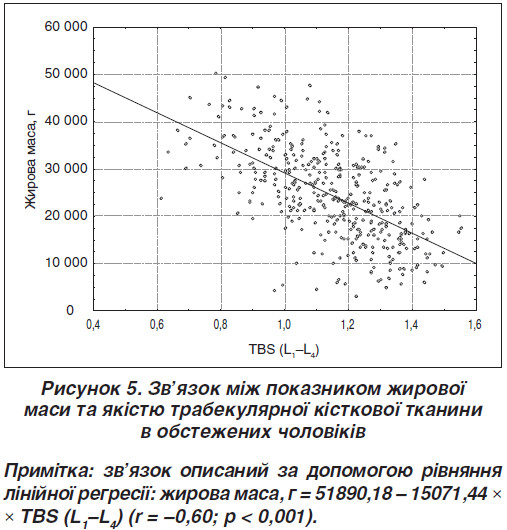
Проте між показником жирової маси та TBS (L1–L4) установлено негативний вірогідний зв’язок (рис. 5).
Обговорення
У дослідженні A.L. Evans та групи авторів було вивчено 100 індивідуально підібраних пар чоловіків і жінок із нормальною масою тіла (ІМТ 18,5–24,9 кг/м2) і ожирінням (ІМТ > 30 кг/м2) віком від 25 до 40 років або від 55 до 75 років. Усім пацієнтам проводилася DXA та оцінювали МЩКТ усього тіла, стегнової кістки та поперекового відділу хребта, а за допомогою кількісної комп’ютерної томографії вивчали трабекулярну кісткову тканину на рівні поперекового відділу хребта. У результаті проведеного дослідження встановлено, що люди з ожирінням мали більшу МЩКТ на рівні поперекового відділу хребта та всього скелета порівняно з обстеженими з нормальною масою тіла (р < 0,01). Установлено, що в жінок з ожирінням якість кісткової тканини вірогідно вища порівняно з жінками з нормальним ІМТ (p = 0,003). Проте при оцінці якості трабекулярної кісткової тканини в чоловіків вірогідних відмінностей між групами не отримано (p = 0,166). Відповідно до отриманих результатів вчені зробили висновок, що дорослі з ожирінням мають вищу МЩКТ, більш товсту та більш щільну кору, а також більшу кількість трабекул, ніж дорослі з нормальною масою тіла [21].
G. Mazzetti та групою авторів було проведене дослідження, метою якого було визначити, чи є зв’язок між ІМТ і TBS залежно від виробника денситометра, оскільки денситометри оцінюють м’які тканини по-різному. Проаналізовано дані 1919 жінок і 811 чоловіків віком ≥ 40 років, які брали участь у канадському багатоцентровому дослідженні остеопорозу. Усім учасникам дослідження було проведено DXA поперекового відділу хребта та TBS (L1–L4) на денситометрі фірми GE Lunar (4 центри) та Hologic (3 центри). У результаті проведеного дослідження встановлена вірогідна негативна кореляція між TBS і ІМТ у чоловіків (r = –0,36, р < 0,0001) та жінок (r = –0,33, р < 0,0001) на денситометрі фірми Hologic. При аналізі даних TBS, отриманих на апараті GE Lunar, вірогідних відмінностей між TBS і ІМТ не було отримано (r = 0 у чоловіків, r = –0,02 у жінок). Проте встановлена вірогідна кореляція між ІМТ та МЩКТ на обох приладах для чоловіків і жінок. Автори зробили такий висновок: ІМТ значно впливає на показники TBS у чоловіків і жінок при вимірюванні на апараті фірми Hologic, але не на денситометрі фірми GE Lunar [19].
В останньому дослідженні китайських науковців, метою якого було визначити вплив жирової тканини та її розподілу на якість кісткової тканини в здорових китайських чоловіків, було обстежено 228 чоловіків віком від 38 до 89 років. Чоловіки були розподілені згідно з ІМТ на 3 групи: 78 чоловіків мали ІМТ ≤ 24 кг/м2 (нормальний), 111 чоловіків — ІМТ 24–28 кг/м2 (надлишкова вага), а інші 39 мали ІМТ ≥ 28 кг/м2 (ожиріння). Визначення МЩКТ, показника TBS і розподіл жирової тканини в організмі досліджували за допомогою DXA. У результаті проведеного дослідження встановлено, що МЩКТ на рівні поперекового відділу хребта збільшувалась із зростанням ІМТ, але не було отримано вірогідних відмінностей між TBS і ІМТ серед трьох груп. Крім того, вченими отримано вірогідний кореляційний зв’язок між показниками жирової маси та МЩКТ поперекового відділу хребта
(r = 0,290, р < 0,001). На відміну від цього встановлена негативна кореляція між TBS і жировою масою (r = –0,220, р = 0,001). Подальший аналіз показав, що більший вплив на показник TBS має андроїдний тип відкладання жирової тканини, ніж геноїдний (r = –0,181). Проте встановлено вірогідний кореляційний зв’язок МЩКТ поперекового відділу хребта з андроїдним та геноїдним типом відкладання жирової тканини [17].
Отримані нами результати узгоджуються з показниками попередніх досліджень, в яких показано, що МЩКТ, але не TBS, пов’язана з більш високим індексом маси тіла.
Висновки
Ожиріння негативно впливає на якість трабекулярної кісткової тканини, хоча показники МЩКТ вірогідно вищі. TBS (L1–L4) значно нижчий у чоловіків з ожирінням порівняно з чоловіками з нормальною масою тіла. Установлено позитивний вірогідний зв’язок між показником жирової маси та МЩКТ на рівні всього скелета, поперекового відділу хребта (L1–L4), шийки стегнової кістки та ультрадистального відділу кісток передпліччя. Проте між показником жирової маси та TBS (L1–L4) установлено негативний вірогідний зв’язок.
Список литературы
1. Bermeo S., Gunaratnam K., Duque G. Fat and bone interactions // Curr. Osteoporos. Rep. — 2014. — Vol. 12, № 2. — P. 235-42.
2. Cao J.J. Effects of obesity on bone metabolism // J. Orthop. Surg. Res. — 2011. — Vol. 15, № 6. — P. 30.
3. Compston J. Obesity and bone // Curr. Osteoporos. Rep. — 2013. — Vol. 11, № 1. — Р. 30-35.
4. Faje A., Klibanski A. Body composition and skeletal health: too heavy? Too thin? // Curr. Osteoporos. Rep. — 2012. — Vol. 10, № 3. — P. 208-16.
5. Gonçalves M.J., Rodrigues A.M., Canhão H., Fonseca J.E. Osteoporosis: from bone biology to individual treatment decision // Acta Med. Port. — 2013. — Vol. 26, № 4. — P. 445-55.
6. Gonnelli S., Caffarelli C., Nuti R. Obesity and fracture risk // Clin. Cases Miner. Bone Metab. — 2014. — Vol. 11, № 1. — P. 9-14.
7. Gower B.A., Casazza K. Divergente ffects of obesity on bone health // J. Clin. Densitom. — 2013. — Vol. 16, № 4. — P. 450-454.
8. Leonard M.B., Zemel B.S., Wrotniak B.H. et al. Tibia and radius bone geometry and volumetric density in obese compared to non-obese adolescents // Bone. — 2015. — Vol. 73. — P. 69-76.
9. Naot D., Cornish J. Cytokines and Hormones That Contribute to the Positive Association between Fat and Bone // Front. Endocrinol. (Lausanne). — 2014. — Vol. 9, № 5. — P. 70.
10. Nielson C.M., Srikanth P., Orwoll E.S. Obesity and fracture in men and women: an epidemiologic perspective // J. Bone Miner. Res. — 2012. — Vol. 27, № 1. — P. 1-10.
11. Rosen C.J., Bouxsein M.L. Mechanisms of disease: is osteoporosis the obesity of bone? // Nature clinical practice. — 2006. — Vol. 2, № 1. — P. 35-43.
12. Sharma S., Randon T.V., Mahajan S. еt al. Obesity: Friend or foe for osteoporosis // J. Midlife Health. — 2014. — Vol. 5, № 1. — P. 6-9.
13. De Laet C., Kanis J.A., Oden A. еt al. Body mass index as a predictor of fracture risk: a meta-analysis // Osteoporos Int. — 2005. — Vol. 16. — P. 1330-1338.
14. Nielson C.M., Marshall L.M., Adams A.L., LeBlanc E.S., Cawthon P.M., Ensrud K., Stefanick M.L., Barrett-Connor E., Orwoll E.S. Osteoporotic Fractures in Men Study Research Group. BMI and fracture risk in older men: the osteoporotic fractures in men study (MrOS) // J. Bone Miner. Res. — 2011. — Vol. 26, № 3. — P. 496-502.
15. Leslie W.D., Orwoll E.S., Nielson C.M., Morin S.N., Majumdar S.R., Johansson H., Odén A., McCloskey E.V., Kanis J.A. Estimated Lean Mass and Fat Mass Differentially Affect Femoral Bone Density and Strength Index but Are Not FRAX Independent Risk Factors for Fracture // J. Bone Miner. Res. — 2014. — Vol. 29, № 11. — P. 2511-2519.
16. Premaor M.O., Compston J.E., Avilés F.F., Pagès-Castellà A., Nogués X., Díez-Pérez A., Prieto-Alhambra D. The Association Between Fracture Site and Obesity in Men: A Population-Based Cohort Study // J. Bone Miner. Res. — 2013. — Vol. 28, № 8. — P. 1771-1777.
17. Lv S., Zhang A., Di W., Sheng Y., Cheng P., Qi H., Liu J., Yu J., Ding G., Cai J., Lai B. Assessment of Fat distribution and Bone quality with Trabecular Bone Score (TBS) in Healthy Chinese Men // Scientific Reports. — 2016. — Vol. 26. — P. 1-8.
18. Weisberg S.P., McCann D., Desai M. et al. Obesity is associated with macrophage accumulation in adipose tissue // J. Clin. Invest. — 2003. — Vol. 112(12). — P. 1796-1808.
19. Mazzetti G., Berger C., Leslie W.D., Hans D., Langsetmo L., Hanley D.A., Kovacs C.S., Prior J.C., Kaiser S.M., Davison K.S., Josse R., Papaioannou A., Adachi J.R., Goltzman D., Morin S. N. Densitometer-Specific Differences in the Correlation Between Body Mass Index and Lumbar Spine Trabecular Bone Score // J. Clin. Densitom. — 2016. — pii: S1094-6950(16). — P. 30185-8 // https://www.ncbi.nlm.nih.gov/pubmed/28034592
20. Hsu Y.H., Venners S.A., Terwedow H.A., Feng Y., Niu T., Li Z., Laird N., Brain J.D., Cummings S.R., Bouxsein M.L., Rosen C.J., Xu X. Relation of body composition, fat mass, and serum lipids to osteoporotic fractures and bone mineral density in Chinese men and women // Am. J. Clin. Nutr. — 2006. — Vol. 83. — P. 146-154.
21. Salamat M.R., Salamat A.H., Janghorbani M. Association between Obesity and Bone Mineral Density by Gender and Menopausal Status // Endocrinol. Metab. — 2016. — Vol. 31. — P. 547-558.
22. Evans A.L., Paggiosi M.A., Eastell R., Walsh J.S. Bone Density, Microstructure and Strength in Obese and Normal Weight Men and Women in Younger and Older Adulthood // J. Bone Miner. Res. — 2015. — Vol. 30, № 5. — P. 920-928.