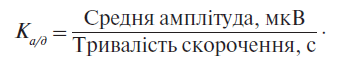Вступ
Цукровий діабет (ЦД) є одним із найбільш поширених неінфекційних захворювань і важливою медико-соціальною проблемою, оскільки сприяє ранній інвалідизації, високій смертності і зниженню якості життя пацієнтів із причини розвитку та прогресування пізніх (хронічних) ускладнень [1–3]. Найбільш часте ускладнення ЦД — діабетична полінейропатія, що на сьогодні розглядається як синдром ураження нервової системи, який патогенетично пов’язаний із неадекватною компенсацією захворювання й станом ендоневрального кровотоку. Поширеність діабетичної полінейропатії залежить від діагностичних критеріїв, віку хворих та тривалості захворювання та коливається від 50 до 100 % [4, 5]. У клінічній практиці виділяють сенсорно-–моторну (дистальну) й автономну (кардіоваскулярну, гастроінтестинальну, урогенітальну, порушення здатності розпізнавати гіпоглікемію, порушення функції зіниці, потових залоз) нейропатію [6].
Про порушення сечовипускання як самостійне ускладнення ЦД уперше повідомив Шарль-Якоб Маршал де Кальві ще в 1864 р., який описав клінічні прояви та можливу роль в їх розвитку ураження нервової системи [7].
Діагностика порушень сечовипускання й оцінка ступеня вираженості на сьогодні проводяться на підставі опитувальників, а також складних інвазивних досліджень (цистоскопія, цистометрія, ультразвукова сонографія, внутрішньовенна пієлографія) [8, 9]. Основним методом функціональної діагностики та об’єктивного оцінювання стану нижніх сечових шляхів є комбіноване уродинамічне дослідження, що включає урофлоуметрію, цистоманометрію, профілометрію, електроміографію (ЕМГ) [10, 11]. Більшість запропонованих діагностичних досліджень є інвазивними, що само по собі є чинником ризику розвитку інфекцій сечовивідних шляхів [12]. На жаль, на сьогодні не розроблено ефективних методів діагностики урогенітальної форми автономної нейропатії при ЦД.
Мета дослідження — оцінити ефективність використання неінвазивних методів дослідження (поверхнева електроміографія, УЗД) при діагностиці порушень сечовипускання в пацієнток із ЦД 1-го типу.
Матеріали та методи
У дослідження включені 184 пацієнтки з ЦД 1-го типу, які підписали інформовану згоду. З дослідження виключалися пацієнтки з гострими та хронічними хворобами нирок і сечовидільної системи, супутніми психічними і неврологічними захворюваннями, патологією нервово-м’язової передачі, гострим порушенням мозкового кровообігу в анамнезі. Наявність і ступінь тяжкості порушень сечовипускання виявлялися за шкалою-опитувальником при ЦД [13], що дозволило припустити в 70 пацієнток (38,04 %) затримку, у 31 пацієнтки (16,85 %) нетримання і в 62 пацієнток (33,69 %) змішану форму порушення сечовипускання. У всіх пацієнток визначалися: рівень глікованого гемоглобіну (НbА1с, %), індекс маси тіла (ІМТ, кг/м2), тривалість захворювання на ЦД. Клінічна характеристика пацієнток наведена в табл. 1.
Реєстрацію поверхневої ЕМГ м’язів тазового дна і сфінктерного апарата уретри проводили за допомогою чотириканального електроміографа «НейроМВП-4» (Росія) за глейзеровським протоколом [14]. У третій пробі (найбільш інформативній) із десятисекундним скороченням визначалися середня амплітуда і тривалість довільного скорочення. Розраховувалося відношення середньої амплітуди до тривалості довільного скорочення (коефіцієнт Ка/д) для кожної групи досліджуваних м’язів (м’язи тазового дна праворуч, ліворуч і зовнішній сфінктер уретри):
Визначальним показником була сума коефіцієнтів: Σ Ка/д = Ка/д м’язів тазового дна справа + Ка/д м’язів тазового дна зліва + Ка/д зовнішнього сфінктера уретри. Результати ЕМГ у обстежуваних пацієнток порівнювалися з результатами контрольної групи (20 здорових жінок віком від 21 до 39 років).
Визначення обсягу залишкової сечі здійснювалося за допомогою ультразвукового сканування сечового міхура апаратом Toshiba, обсяг залишкової сечі визначався за алгоритмом L × D × W.
Результати
При використанні шкали-опитувальника при ЦД було виявлено, що не висувала скарг на порушення сечовипускання 21 пацієнтка (11,4 %) (табл. 2).
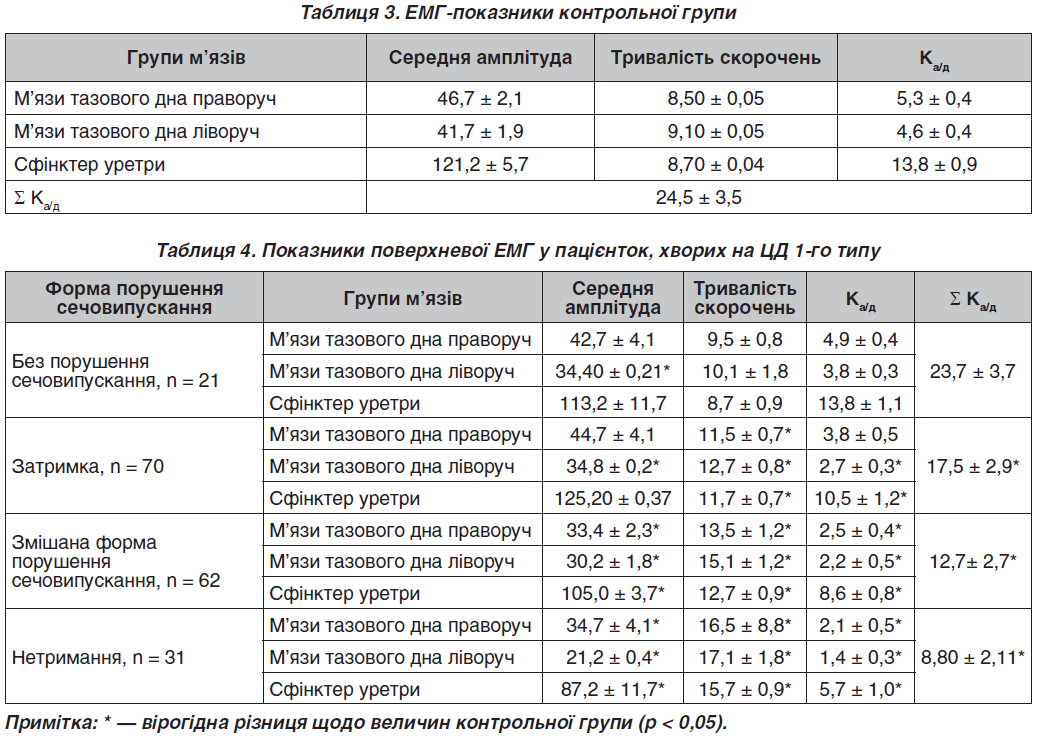
За результатами поверхневої ЕМГ найбільшу середню амплітуду скорочень серед досліджуваних м’язів у контрольній групі розвивав сфінктерний апарат уретри (табл. 3).
Амплітуда скорочень м’язів тазового дна зліва порівняно з правим боком становила 91,8 і 89,5 % відповідно, що можна трактувати як ознаки функціональної асиметрії скорочень однойменних груп м’язів з обох боків.
Показники поверхневої ЕМГ у пацієнток, хворих на ЦД 1-го типу, наведені в табл. 4.
У пацієнток у групі без порушень сечовипускання відзначалося зниження амплітуд кривих м’язів сфінктерного апарата уретри на 6,3 %, при цьому амплітуда дикротичної частини, що, як і в групі контролю, починалася на 7,8 ± 0,2 секунди, була знижена на 78 %.
У цих пацієнток спостерігалося зниження амплітуд скорочень м’язів тазового дна ліворуч до 82,5 % від контрольних значень і збільшилися асиметрії амплітуд м’язів тазового дна на 19,7 %. Значення середніх частот скорочень можна було порівняти з контрольною групою, але було виявлено підвищення частоти кінцевої частини скорочень сфінктерного апарата уретри до 109 коливань в 1 с, що розцінювалося як компенсаторне. Виявлено збільшення тривалості скорочень, що було найбільшим у м’язів тазового дна ліворуч (до 21,4 %).
У пацієнток із затримкою сечі амплітуда кривих ЕМГ м’язів сфінктерного апарата уретри збігалася з такою в групі контролю, була знижена амплітуда скорочень м’язів тазового дна зліва до 83,3 % (34,8 ± 0,2 мкВ, р < 0,05). Також виявлено збільшення до 21,4 % тривалості скорочень, що було найбільшим у м’язах тазового дна зліва (12,7 ± 0,8 с, р < 0,05). У пацієнток на 22,1 % збільшилися значення асиметрії амплітуд м’язів тазового дна за рахунок
м’язів лівого боку. Значення середніх частот скоро–чень можна було порівняти із показниками конт–рольної групи, але було виявлено підвищення частоти кінцевої частини скорочень до 127 коливань в 1 с.
У пацієнток зі змішаною формою порушення сечовипускання виявлено збільшення тривалості скорочень із подовженням часу анакротичної і, особливо, дикротичної частини. Найбільше це зазначалося у м’язах тазового дна зліва — до 1,65 раза (15,1 ± 1,2 с, р < 0,05). Найбільше зниження амплітуд кривих (до 71,5 % справа і 77,2 % зліва) було у м’язів тазового дна справа. Зазначалося згладжування ступеня асиметрії до 9 %. У процесі дослідження виявлена відсутність значущої контрактильної здатності (до 13,8 ± 0,4 мкВ) на 13–14-й секунді скорочення. Сума коефіцієнтів Ка/д у даній групі вірогідно знижувалася (12,7 ± 2,7 мкВ/с, р < 0,05).
Середня амплітуда скорочень у пацієнток із нетриманням сечі була найменшою у м’язів тазового дна зліва — до 50,8 % від контролю (21,2 ± 0,4 мкВ, р < 0,05). Ступінь асиметрії за рахунок зниження амплітуди скорочень м’язів тазового дна зліва становив 38,3 %. Також відзначено максимальне збільшення тривалості періоду скорочення в 1,9 раза в м’язів тазового дна зліва (17,1 ± 1,8 с, р < 0,05) із подовженням дикротичної частини кривої до 5 секунд. Установлено, що сума коефіцієнтів Ка/д у даній групі вірогідно знижувалася (8,8 ± 2,1 мкВ/с, р < 0,05).
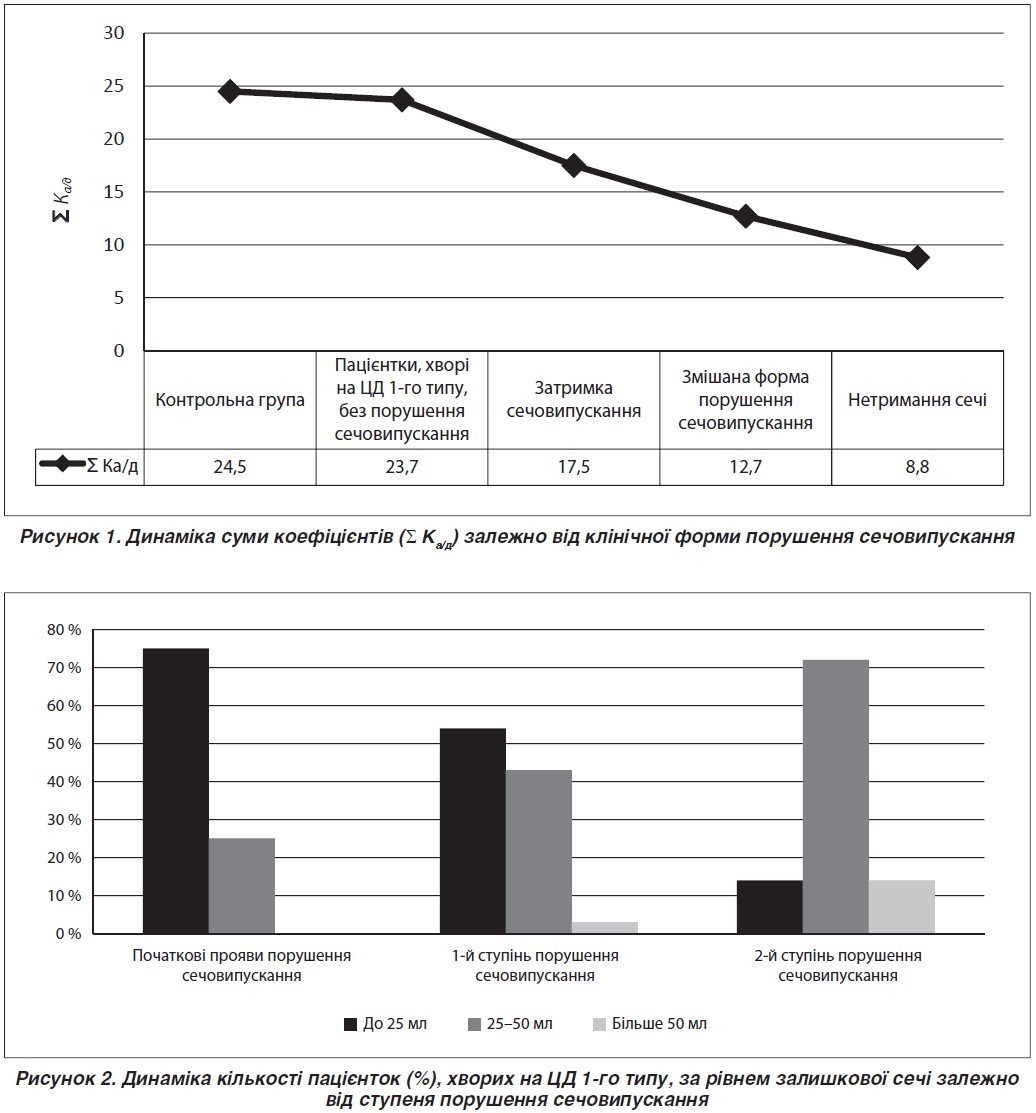
Динаміка суми коефіцієнтів (Σ Ка/д) залежно від клінічної форми порушення сечовипускання подана на рис. 1.
У процесі дослідження доведено максимальне вірогідне зниження даного коефіцієнта при нетриманні сечі (8,8 ± 2,1 мкВ/с) щодо як контрольної групи, так і групи без порушення сечовипускання (24,5 ± 3,5 мкВ/с і 23,7 ± 3,7 мкВ/с відповідно).
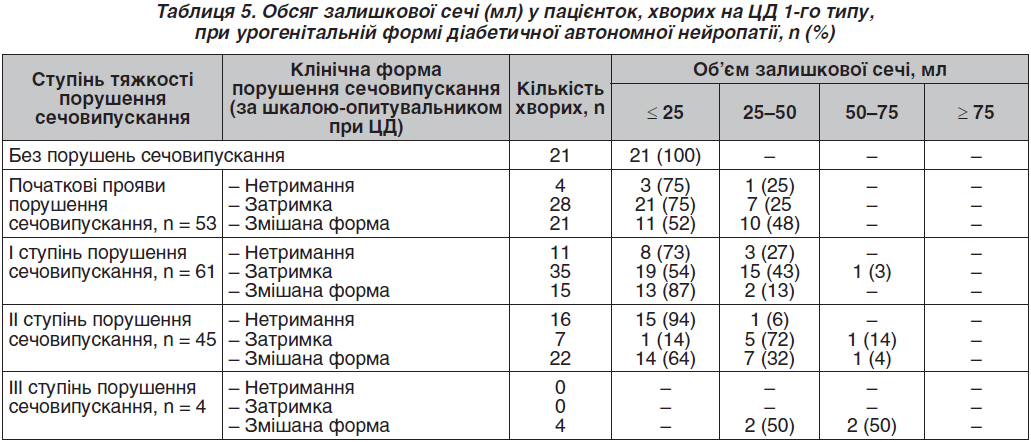
У пацієнток, у яких за даними шкали-опитувальника при ЦД порушення сечовипускання не виявлялися (21 пацієнтка), кількість залишкової сечі за результатами УЗД сечового міхура не визначалася або була меншою за 25 мл (табл. 5).
Обговорення
При затримці сечі серед 28 пацієнток у 25 % із них (7 пацієнток) кількість залишкової сечі визначалася в другому вимірювальному діапазоні (25–50 мл). При змішаній формі порушення сечовипускання в пацієнток із початковими проявами порушення сечовипускання кількість залишкової сечі в цьому діапазоні визначалася в 48 % пацієнток. Установлено, що I ступінь порушення сечовипускання діагностовано у 8 (73 %) пацієнток із нетриманням сечі, причому переважали особи з мінімальною кількістю залишкової сечі. Кількість залишкової сечі в інших досліджуваних із цим ступенем порушення сечовипускання визначалася в другому вимірювальному діапазоні.
Серед пацієнток із затримкою при I ступені порушення сечовипускання в 54 % жінок кількість залишкової сечі була мінімальною, у 43 % — залишкова сеча визначалася в другому вимірювальному діапазоні, і в однієї пацієнтки (3 %) установлена патологічна кількість залишкової сечі (70 мл — третій вимірювальний діапазон). У пацієнток зі змішаною формою порушення сечовипускання при I ступені порушення сечовипускання кількість залишкової сечі не виходила за рамки другого вимірювального діапазону (25–50 мл).
При II ступені порушення сечовипускання більшість пацієнток із нетриманням (94 %) мали мінімальну кількість залишкової сечі (до 25 мл). Серед пацієнток із затримкою сечі в цій групі 72 % пацієнток мали кількість залишкової сечі від 25 до 50 мл, 14 % — патологічну кількість залишкової сечі (понад 50 мл). У групі зі змішаною формою порушення сечовипускання при II ступені порушення сечовипускання також була одна пацієнтка з патологічною кількістю залишкової сечі (60 мл).
У групі з III ступенем порушення сечовипускання були тільки пацієнтки зі змішаною формою порушення сечовипускання, серед яких у двох пацієнток (50 %) кількість залишкової сечі визначалася в другому, а ще у двох — у третьому вимірювальному інтервалі (50–75 мл).
Динаміка показників залишкової сечі в пацієнток із затримкою сечі при ЦД 1-го типу подана на рис. 2.
Таким чином, кількість залишкової сечі, що визначається за допомогою УЗД-сканування сечового міхура, у пацієнток із затримкою збільшується з підвищенням ступеня порушення сечовипускання. Серед пацієнток із нетриманням у всіх групах (31 пацієнтка) тільки в 5 пацієнток (16 %) кількість залишкової сечі, за даними УЗД-контролю, перевищувала 25 мл. У решти жінок залишкова сеча не визначалась або її кількість була мінімальною.
Висновки
1. Вивчення скоротливої здатності м’язів тазового дна і сфінктерного апарата уретри дозволяє додатково до результатів шкали-опитувальника при ЦД визначити можливу клінічну форму порушень сечовипускання в пацієнток із ЦД 1-го типу.
2. Показники поверхневої ЕМГ змінюються залежно від клінічної форми порушення сечовипускання. При затримці відзначається підвищення тонусу м’язів урогенітальної зони як наслідок формування феномена денерваційної гіперчутливості. Нетримання сечі супроводжується дифузною демієлінізацією сенсорних і моторних нервових стовбурів із грубим аксональним компонентом унаслідок посилення вегетативно-трофічних порушень м’язового апарата урогенітальної зони.
3. При пробі з 10-секундними скороченнями досліджуваних м’язів визначення відношення середньої амплітуди до тривалості довільного скорочення (коефіцієнт Ка/д) для кожної групи досліджуваних м’язів з обчисленням суми коефіцієнтів (Σ Ка/д) є додатковим інформативним показником для діагностики клінічної форми порушення сечовипускання при ЦД 1-го типу.
4. Кількість залишкової сечі, що визначається за допомогою УЗД-контролю, у пацієнток із затримкою збільшується з підвищенням ступеня порушення сечовипускання.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Международная диабетическая федерация (IDF), сайт. — Режим доступа: http://www.idf.org.
2. Эндокринология: Нац. рук. / Под ред. И.И. Дедова, Г.А. Мельниченко. — М.: ГЭОТАР-Медиа, 2008. — 1072 с.
3. Забаровская З.В. Место бенфотиамина в лечении поздних обсложнений сахарного диабета / З.В. Забаровская, Е.И. Шишко, О.В. Забаровская // Лечебное дело. — 2013. — № 5(33). — С. 13-17.
4. Сахарный диабет. Клиника, диагностика, поздние осложнения, сахароснижающая и метаболическая терапия: Учеб.-метод. пос. / В.И. Бородина [и др.]. — М.: Медпрактика, 2009. — 60 с.
5. Brownlee M. Biochemistry and molecular cell biology of diabetic complications / M. Brownlee // Nature. — 2001. — Vol. 414(6865). — P. 813-820.
6. Kempler P. Autonomic neuropaty: a marker of cardiovascular risk / P. Kempler // Br. J. Diabetes Vasc. Dis. — 2003. — Vol. 68, № 11. — P. 84-90.
7. Marshal de Calvi Ch.-J. Recherches sur lessaccidents diabeticques et assai dune theorie generale de diabete. — Asselin und Labe. — 1864. — 658 p.
8. Котов С.В. Диабетическая нейропатия / С.В. Котов, А.П. Калинин, И.Г. Рудаков. — М.: Медицина, 2000. — 150 с.
9. Вегетативные расстройства / Под ред. А.М. Вейна. — М.: Мед. информ. агентство, 2000. — 390 с.
10. Аляев Ю.Г. Расстройства мочеиспускания / Ю.Г. Аляев, В.А. Григорян, З.К. Гаджиева. — М.: Литература, 2006. — 208 с.
11. Пирогов В.А. Методы диагностики и лечения гиперактивного мочевого пузыря / В.А. Пирогов // Медицинские аспекты здоровья женщины. — 2009. — № 8(25). — С. 25-27.
12. Хайкина Е.В. Инфекции мочевыводящих путей у больных сахарным диабетом / Е.В. Хайкина, Г.К. Решедько, М.В. Морозов // Клиническая микробиол. и антимикроб. химиотерапия. — 2008. — Т. 3, № 3. — С. 36-44.
13. Ткачук Е.Ю. Клиническая диагностика нарушений акта мочеиспускания у больных сахарным диабетом / Е.Ю. Ткачук, Н.А. Кравчун // Пробл. эндокрин. патол. — 2016. — № 2. — С.47-53.
14. Treatment of Vulval Vestibulitis Syndrome wich Electromyographic Biofeedback of Pelvic Floor Musculature / H.I. Glazer, G. Rodke, C. Swensionis et al. // J. Reprod. Med. — 1995. — Vol. 40. — P. 283-290.