Введение
Согласно докладу комитета Всемирной организации здравоохранения (ВОЗ) по ожирению, избыточная масса тела и ожирение в настоящее время столь распространены, что влияют на здоровье населения больше, чем традиционные проблемы здравоохранения, в частности, голодание и инфекционные заболевания [1]. Распространенность ожирения увеличивается с возрастом, а после 50–60 лет масса тела обычно стабилизируется [2]. Более того, ожирение является фактором риска развития многих заболеваний и связано со значительным числом состояний, приводящих к смерти [3]. К ним относятся сердечно-сосудистые заболевания, артериальная гипертензия (АГ), новообразования, нарушение свертываемости крови и функции дыхательной системы, заболевания опорно-двигательного аппарата и кожи, а также репродуктивные расстройства как у мужчин, так и у женщин [4].
По классификации ВОЗ различают эндокринное (алиментарное, гипотиреоидное, гипофизарное, железистое) и простое ожирение (избыточное, конституциональное, локализованное, экзо- и эндогенное). В основе базисной терапии, назначаемой всем пациентам с ожирением, лежит изменение образа жизни (гипокалорийное питание, адекватная двигательная активность, поведенческая терапия). Базисная терапия без медикаментозного лечения возможна у пациентов репродуктивного возраста с глютеофеморальным типом ожирения II степени при значении индекса инсулинорезистентности менее 2,83, уровне лептина не более 57 нг/мл, содержании триглицеридов, не превышающем 1,38 ммоль/л [5].
Данные литературы свидетельствуют о том, что при лечении ожирения в 95 % случаев не удается на длительное время снизить массу тела, большинство пациенток возвращаются к исходному весу в течение года [6, 7]. Несмотря на то, что в последние годы существенно изменились принципы терапии ожирения, ее эффективность остается чрезвычайно низкой ввиду отсутствия системного подхода к этой проблеме, отсутствуют четкие алгоритмы диагностики и лечения ожирения у женщин репродуктивного возраста.
Таким образом, несмотря на имеющиеся научные работы по данной проблеме, ряд вопросов остается недостаточно освещенным, аргументация авторов в ряде случаев неубедительна. Вышеизложенное определяет актуальность исследований, направленных на разработку комплексного подхода к лечению ожирения у женщин молодого возраста с учетом особенностей метаболического и гормонального дисбаланса, пищевого поведения и репродуктивных нарушений, способного улучшить качество жизни больных и снизить риск сопутствующих ожирению заболеваний.
Все это послужило основанием для проведения настоящего исследования.
Цель исследования: изучить эффективность патогенетической терапии и динамику антропометрических показателей у женщин с ожирением фертильного возраста при различных эндокринопатиях до и через 6 месяцев после лечения.
Материалы и методы
Изучены особенности репродуктивного здоровья у 51 женщины с ожирением различного генеза, обратившихся по поводу бесплодия в РСНПЦЭ в 2014–2015 гг. Группа контроля состояла из 20 женщин с ожирением различной степени без нарушений менструального цикла.
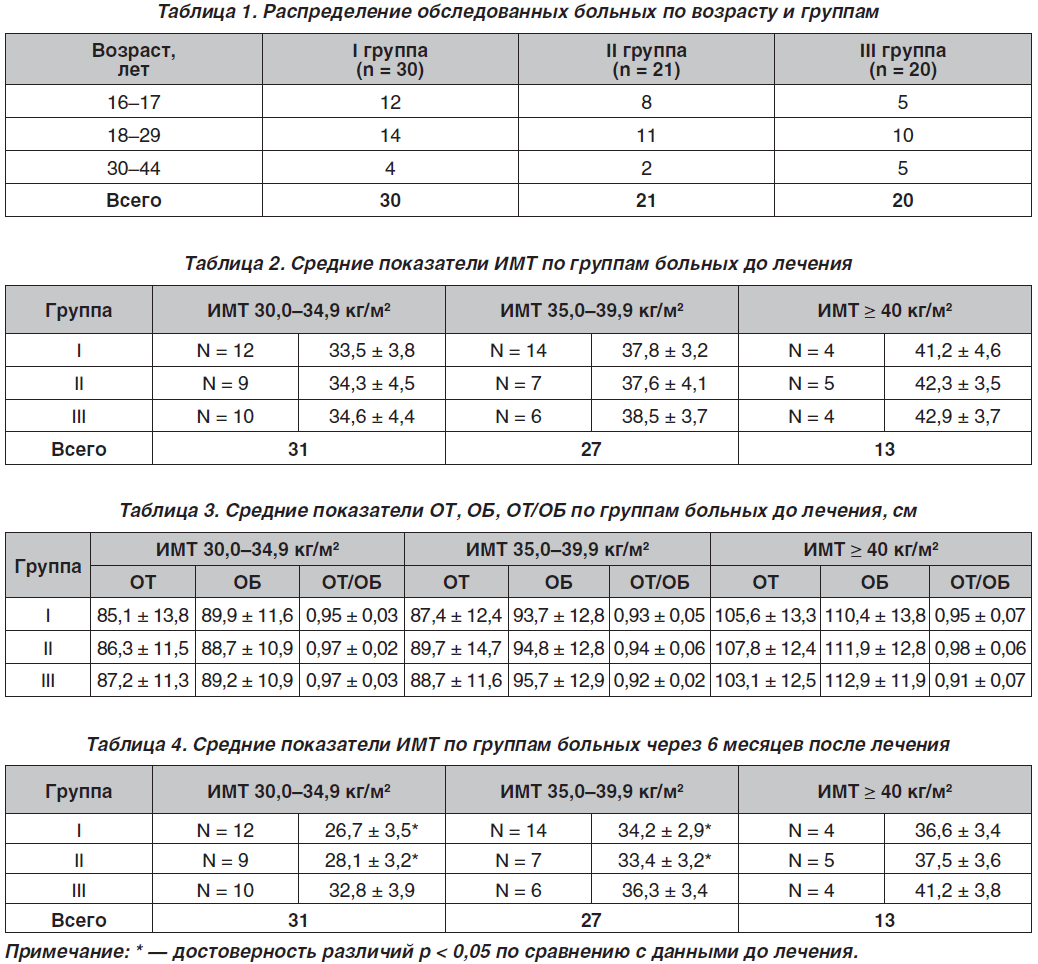
По этиологическому фактору пациентки с ожирением были распределены на три группы. Первую группу составили 30 пациенток с ожирением при синдроме поликистозных яичников, вторую группу — 21 пациентка с диэнцефальным ожирением. Контрольную группу составили 20 пациенток с эндокринным ожирением при первичном гипотиреозе. Возраст пациенток в первой группе колебался от 20 до 39 лет и в среднем составил 28,30 ± 0,64 года, во второй группе — 30,40 ± 0,51 года и в третьей группе — 29,40 ± 0,51 года.
Всем больным проводился спектр исследований, включавший общеклинические, биохимические (общий анализ крови, мочи, липидограмма, аланин–аминотрансфераза, аспартатаминотрансфераза, били–рубин), гормональные методы исследования крови (пролактин, лютеинизирующий гормон, фолликулостимулирующий гормон, инсулин, эстрадиол, прогестерон, свободный тестостерон, тиро–ксин, антимюллеров гормон, 17-оксипрогестерон, дегидроэпиандростендион, а также соматотропный гормон, инсулиноподобный фактор роста 1), электрокардиография, ультразвуковое исследование матки и яичников с фолликулометрией на 11–14-й дни цикла. Всем пациенткам была выполнена магнитно-резонансная томография гипофиза, а также электроэнцефалография для подтверждения диэнцефального ожирения. При необходимости выполнялся пероральный глюкозотолерантный тест.
Антропометрическое исследование проводилось при первичном осмотре, в динамике и включало определение роста, массы тела, индекса массы тела (ИМТ), рассчитываемого по формуле: ИМТ (кг/м2) = (масса тела, кг) / (рост, м2). В соответствии со значениями ИМТ, рекомендованными ВОЗ (1997), определялась степень ожирения. Определение характера распределения жировой ткани проводилось в соответствии с коэффициентом (отношением) длины окружности талии (ОТ) к длине окружности бедер (ОБ). Коэффициент ОТ/ОБ более 0,85 расценивали на основании рекомендаций ВОЗ как абдоминальное ожирение, менее указанного значения — как глютеофеморальное.
Пациенткам для снижения массы тела была назначена немедикаментозная и этиопатогенетическая терапия. Немедикаментозная терапия включала общие рекомендации по измерению веса, подсчет суточных калорий, а также отказ от легкоусвояемых углеводов. Этиопатогенетическая терапия включала три схемы терапии в трех группах пациенток в течение 6 месяцев. Первой группе больных была назначена комбинация метформин (1000 мг/сутки) + верошпирон (100 мг дважды в неделю) + йодид калия (100 мг/сутки) + левотироксин (50 мг утром) + антиандрогенные препараты + антидепрессанты (амитриптилин, фенибут, рексетин и др.).
Второй группе была назначена комбинация метформин (1000 мг в сутки) + верошпирон (100 мг дважды в неделю) + йодид калия (100 мг/сутки) + левотироксин (50 мг/сутки) + метаболическая терапия (пирацетам, актовегин) + редуксин (15 мг/сутки) + антидепрессанты (амитриптилин, фенибут, рексетин и др.).
Третьей группе больных назначена комбинация йодид калия (100 мг/сутки) + левотироксин (50 мг/сутки).
Полученные данные обрабатывали с помощью компьютерных программ Microsoft Excel и Statistica 6. Вычислялись средние значения (М), стандарт–ные отклонения средних (m). Достоверность различий в уровне между группами оценивалась по величине доверительного интервала и критерия Стьюдента (р). Различия считали статистически значимыми при р < 0,05.
Результаты
В табл. 1 приведено распределение больных по возрасту в группах. Как видно из табл. 1, большую часть составили пациентки в возрасте от 18 до 29 лет — 35 случаев (49,2 %). По мере увеличения сроков заболевания возрастал и показатель ИМТ.
В табл. 2 представлены данные антропометрии по группам больных до лечения. Как видно из данных табл. 2, наиболее часто встречались пациенты с ожирением I степени во всех группах.
Cредние значения ОТ, ОБ, ОТ/ОБ соответствовали показателям ИМТ по группам и возрастали при их увеличении (табл. 3).
На первом этапе лечения нарушений менструального цикла и ановуляторного бесплодия у женщин с ожирением осуществлялась коррекция избыточной массы тела. Далее лечение выполняли по вышеуказанным схемам в группах. В табл. 4 представлены данные антропометрических показателей по группам больных через 6 месяцев после лечения.
Как видно из табл. 4, в первой и второй группах пациенток отмечалось достоверное снижение ИМТ после шести месяцев лечения, в то время как у пациенток третьей группы достоверных изменений ИМТ после лечения не было достигнуто. При этом у пациенток первой и второй групп с ожирением III степени через 6 месяцев была достигнута тенденция к снижению ИМТ.
Кроме того, восстановление фертильности и беременность были достигнуты у 10 пациенток первой группы (19,5 %).
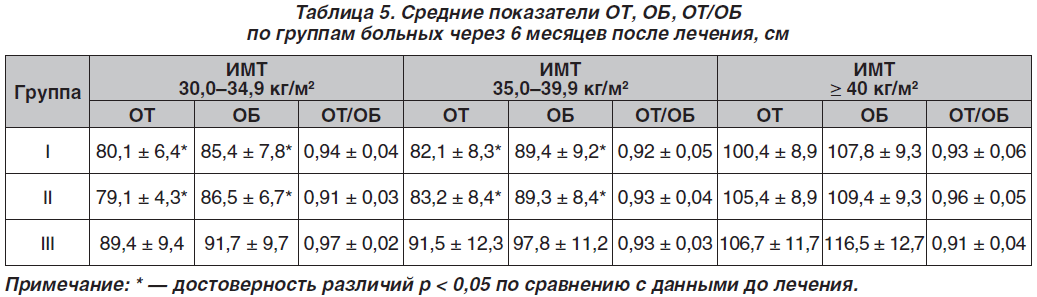
В табл. 5 представлены данные ОТ, ОБ, ОТ/ОБ по группам больных через 6 месяцев после лечения.
Как видно из данных, приведенных в табл. 5, в первой и второй группах пациенток отмечалось достоверное улучшение показателей по сравнению со средними данными ОТ, ОБ, ОТ/ОБ до лечения, в то время как у пациенток третьей группы достоверных изменений средних значений ОТ, ОБ, ОТ/ОБ через 6 месяцев лечения не установлено.
Обсуждение результатов
Жировая ткань является источником продукции биологически активных веществ, гормонов, провоспалительных цитокинов, что приводит к снижению функции иммунной системы, нарушениям гормонального гомеостаза у женщин с избыточной массой тела. Результатом активации оси «гипоталамус — гипофиз — надпочечники» является формирование висцерального ожирения, инсулинорезистентности (гиперинсулинемии), дислипидемии и АГ [8]. Следствием эндокринно-метаболических нарушений является в репродуктивном возрасте ановуляторное бесплодие.
Подобно многим патологическим состояниям, ожирение способствует развитию других заболеваний, в том числе и нарушений репродуктивной функции, и отягощает уже имеющиеся нарушения фертильности [9]. Несмотря на это, функциональное состояние половых желез при ожирении до сих пор изучено недостаточно. В литературе имеются лишь отдельные работы, посвященные этому вопросу, в которых ограничиваются изучением уровня суммарных эстрогенов (эстрона, эстрадиола и эстриола) у женщин с ожирением [10, 11]. При этом ожирение у женщин репродуктивного возраста имеет преимущественно абдоминальный характер.
Через 6 месяцев в первой группе больных наблюдалось снижение ИМТ с 43,5 до 42,6 кг/м2. Во второй группе нами выявлено значительное снижение массы тела больных на 8,9 кг. В первой и второй группах пациенток отмечалось достоверное улучшение показателей антропометрии при ожирении I и II степени, ОТ, ОБ, ОТ/ОБ по сравнению с данными до лечения. В то же время у пациенток третьей группы достоверных изменений ИМТ, ОТ, ОБ, ОТ/ОБ через 6 месяцев лечения не установлено. Кроме того, восстановление фертильности и беременность были достигнуты у 19,5 % пациенток первой группы.
Выводы
Включение метформина в комплексное лечение больных с ожирением способствует достоверному снижению ИМТ. Это косвенно указывает на тот факт, что в исследуемых группах женщин ожирение является основным проявлением метаболического синдрома.
Оптимизация лечения ожирения у женщин репродуктивного возраста основана на составлении индивидуальных программ, выбор которых определяется значениями антропометрических показателей, состоянием гормонального и метаболического статуса, особенностями пищевого поведения и личностно-эмоциональной сферы, менструальной и репродуктивной функции.
Проведение комплекса лечебных мероприятий с учетом разработанного алгоритма индивидуального подбора терапии ожирения позволяет эффективно снижать и удерживать достигнутую массу тела, способствует улучшению соматического и репродуктивного здоровья у женщин детородного возраста.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Glintborg D., Andersen M. An update on the pathoge–nesis, inflammation, and metabolism in hirsutism and polycystic ovary syndrome // Gynecological endocrinology. — 2010. — Vol. 26(4). — P. 281-296. — doi: 10.3109/09513590903247873.
2. Garruti G., Depalo R., Vita M.G. et al. Adipose tissue, me–tabolic syndrome and polycystic ovary syndrome: from pathophysiology to treatment // Reproductive biomedicine online. — 2009. — Vol. 19(4). — P. 552-563.
3. Samad F., Badeanlou L., Shah C., Yang G. Adipose tissue and ceramide biosynthesis in the pathogenesis of obesity // Advances in experimental medicine and biology. — 2011. — Vol. 721. — P. 67-86. — doi: 10.1007/978-1-4614-0650-1_5.
4. Ouchi N., Parker J.L., Lugus J.J., Walsh K. Adipokines in inflammation and metabolic disease // Nature reviews Immuno–logy. — 2011. — Vol. 11(2). — P. 85-97. — doi: 10.1038/nri2921; PubMed Central PMCID: PMC3518031.
5. Mangge H., Almer G., Truschnig-Wilders M. et al. Inflammation, adiponectin, obesity and cardiovascular risk // Current medicinal chemistry. — 2010. — Vol. 17(36). — P. 4511-4520.
6. Toulis K.A., Goulis D.G., Mintziori G. et al. Meta-analysis of cardiovascular disease risk markers in women with polycystic ovary syndrome // Human reproduction update. — 2011. — Vol. 17(6). — P. 741-760. — doi: 10.1093/humupd/dmr025.
7. Chakrabarti J. Serum leptin level in women with polycystic ovary syndrome: correlation with adiposity, insulin, and circulating testosterone // Annals of medical and health sciences research. — 2013. — Vol. 3(2). — P. 191-196. — doi: 10.4103/2141-9248.113660; PubMed Central PMCID: PMC3728861.
8. Yildizhan R., Ilhan G.A., Yildizhan B. et al. Serum retinol-binding protein 4, leptin, and plasma asymmetric dimethylarginine levels in obese and nonobese young women with polycystic ovary syndrome // Fertility and sterility. — 2011. — Vol. 96(1). — P. 246-250. — doi: 10.1016/j.fertnstert.2011.04.073.
9. Costello M., Shrestha B., Eden J. et al. Insulin-sensitising drugs versus the combined oral contraceptive pill for hirsutism, acne and risk of diabetes, cardiovascular disease, and endometrial cancer in polycystic ovary syndrome // The Cochrane database of systematic reviews. — 2007. — CD005552 Epub 2007/01/27. doi: 10.1002/14651858.CD005552.pub2.
10. Basios G., Trakakis E., Chrelias C. et al. The impact of metformin treatment on adiponectin and resistin levels in women with polycystic ovary syndrome: a prospective clinical study // Gynecological endocrinology. — 2015. — Vol. 31(2). — P. 136-140. — doi: 10.3109/09513590.2014.975684.
11. Hamed H.O. Role of adiponectin and its receptor in prediction of reproductive outcome of metformin treatment in patients with polycystic ovarian syndrome // The journal of obstetrics and gynaecology research. — 2013. — Vol. 39(12). — P. 1596-1603. — doi: 10.1111/jog.12101.