Щитоподібна залоза (ЩЗ) — найбільший орган внутрішньої секреції організму людини. Головною функцією тиреоїдних гормонів є підтримання основного обміну й регуляція тканинного дихання. Стимуляція рецепторів тиреоїдних гормонів зумовлює зміну експресії генів із відповідними метаболічними ефектами, головним із яких є стимуляція основного обміну.
Без гормонів ЩЗ або при їх нестачі неможливий нормальний розвиток жодної функціональної системи організму; гормони регулюють клітинний цикл і проліферацію тканин, їх фізіологічну й посттравматичну репарацію. Регулюючи експресію генів, тиреоїдні гормони забезпечують реалізацію генотипу в фенотип, тобто в конкретний людський образ (при відсутності ЩЗ без замісної терапії розвивається кретинізм, що підкреслює значення гормонів для фенотипу). Яку б геніальну спадкову інформацію, одержану від предків, не мала б дитина, за відсутності тиреоїдних гормонів вона не буде реалізована.
Гіпоталамо-гіпофізарно-тиреоїдна система функціонує за принципом зворотних зв’язків. Як основну ланку механізму зворотного зв’язку розглядають зміну чутливості клітин аденогіпофіза до стимулюючої дії тиреоліберину залежно від концентрації тиреоїдних гормонів. Рівень тиреоїдних гормонів у периферичних тканинах визначає вироблення гіпоталамічного тиреоліберину, який, у свою чергу, регулює біосинтез і вивільнення в портальну систему гіпофіза тиреотропного гормону (ТТГ). Розвиток гіпоталамо-гіпофізарного контролю функції ЩЗ у людини відбувається в період між 20-м і 30-м тижнями антенатального розвитку й упродовж першого місяця постнатального життя. Тиреоліберин був не лише першим виявленим, але й першим штучно синтезованим і першим введеним людині гіпоталамічним гормоном. Для його виділення (у 1969 р.) необхідно було одержати 50 тонн гіпоталамічної тканини 300 000 овець. Введення тиреоліберину спричинює швидке підвищення рівня ТТГ у крові, що досягає максимуму через 15–45 хв і нормалізується через 1–4 год.
ТТГ стимулює поглинання залозою йодиду з крові, підвищуючи активність йодидної помпи або збільшуючи число таких помп на базальній мембрані фолікулярних клітин, підвищує активність тирео–їдної пероксидази (ТПО) і посилює синтез тиреоглобуліну.
В основі регуляції секреції ТТГ лежить механізм негативного й позитивного зворотного зв’язку: високі концентрації вільних тироксину (Т4) і трийодтироніну (Т3) інгібують, а низькі — стимулюють його викид. В аденогіпофізі дейодування Т4 з утворенням Т3 здійснюється інтенсивніше, ніж у периферичних тканинах. Саме тому рівень ТТГ, що визначається в крові, не зазнає миттєвих змін при призначенні того чи іншого лікарського препарату.
Принцип зворотної аферентації, або принцип зворотних зв’язків у гіпоталамо-гіпофізарно-тирео–їдній системі, лежить в основі дослідження функ–ціонального стану ЩЗ у нормі й при різних захворюваннях.
Особливий інтерес викликають рецептори ТТГ, оскільки за певних обставин вони набувають властивостей антигенів, до яких виробляються різні автоантитіла, і цей процес відіграє дуже важливу роль у патології ЩЗ.
ТТГ синтезується базофільними клітинами передньої частки гіпофіза. Тиреотрофи становлять 3–5 % клітин цієї частки. Молекула ТТГ складається з двох різних нековалентно зв’язаних субодиниць: α-субодиниці, ідентичної за амінокислотним складом α-субодиниці лютеїнізуючого й фолікулостимулюючого гормонів, хоріонічного гонадотропіну, і β-субодиниці, що визначає імунобіологічну й біологічну специфічність кожного з них. Вважають, що α-субодиниця відповідає за функцію розпізнавання рецептора й подальше утворення гормонорецепторного комплексу, після чого β-ланцюжок активує відповідні ферментні системи й приводить до специфічної біологічної реакції.
ТТГ притаманний добовий ритм секреції. Пік вивільнення ТТГ припадає на години перед початком сну, хоча підвищення його вмісту в сироватці розпочинається в післяполудневий час. Ця особливість (нічне вивільнення) порушується при тривалому голодуванні, гіпотиреозі центрального генезу, тиреотоксикозі й замісній терапії левотироксином (LT4). Циркадний ритм секреції ТТГ формується через 1–1,5 місяця після народження й зберігається впродовж усього життя. З віком у здорових осіб знижується чутливість до стимулюючого впливу тиреоліберину, що супроводжується зменшенням кількості рецепторів ТТГ. Цей факт значною мірою пояснює дещо вищий рівень ТТГ, що спостерігається в осіб похилого віку без ознак гіпотиреозу. У похилому віці знижується вміст вільних фракцій тирео–їдних гормонів у крові, що відображує зміну порогу чутливості гіпофіза й встановлення нових відношень у зворотному зв’язку регуляції ТТГ.
Упродовж останніх трьох десятиліть суттєво вдосконалені лабораторні методи, що застосовуються для діагностики захворювань ЩЗ. Якщо до середини 70-х років минулого століття практично єдиними лабораторними методами оцінки функціонального стану ЩЗ були виявлення зв’язаного з білками йоду й визначення рівня холестерину в крові, то протягом наступних 40 років змінилося вже кілька поколінь тестів для діагностики тиреоїдних захворювань in vitro: від класичних радіоімунологічних до сучасних високочутливих імунохемілюмінесцентних методів визначення рівня гормонів ЩЗ і ТТГ у крові.
Змінилися й підходи до вибору оптимальних методів діагностики порушень функції ЩЗ. На сьогодні тестом першого рівня, що застосовують на початковому етапі діагностичного пошуку й при скринінгу вродженого гіпотиреозу в новонароджених, вважається визначення концентрації ТТГ чутливим методом, а не аналіз рівня гормонів ЩЗ. Без визначення рівня ТТГ, за сучасними уявленнями, оцінка функції ЩЗ у більшості випадків некоректна.
Лабораторні методи посідають одне з провідних місць у діагностиці захворювань ЩЗ, вони поділяються на три основні групи:
— визначення ТТГ гіпофіза й гормонів ЩЗ (Т4 і Т3), що свідчить про функціональний стан залози;
— визначення концентрації поліпептидів, що синтезуються в тканині ЩЗ (тиреоглобуліну, кальцитоніну) і вважаються важливими маркерами онкологічної патології ЩЗ;
— визначення антитіл до антигенів клітин ЩЗ (тиреоглобуліну, ТПО, рецептора ТТГ), що дозволяють діагностувати автоімунні, захворювання ЩЗ.
Розробка принципово нових, неізотопних технологій гормонального імунологічного аналізу, що ґрунтуються на використанні флюорометричного методу й методу посиленої люмінесценції, дозволила підвищити чутливість методу визначення ТТГ до рівня менше від 0,01 мМО/л (методики другого покоління) і навіть менше від 0,001 мМО/л (методики третього покоління), а вільних форм Т4 (вТ4) і Т3 (вТ3) — до рівня менше від 0,5 пмоль/л. До переваг неізотопних методів належать їх висока продуктивність, можливість тривалого збереження й використання наборів (до шести місяців і більше), відсутність забруднення навколишнього середовища радіоактивними ізотопами. Тому неізотопні методи поступово витісняють класичні радіоізотопні методи.
Уміст ТТГ у людей в еутиреоїдному стані перебуває в межах 0,4–4,0 мМО/л. У випадку первинного гіпотиреозу рівень ТТГ підвищується. Для субклінічного гіпотиреозу характерне підвищення рівня ТТГ, при цьому концентрація Т4 у крові перебуває в межах норми. Низький рівень ТТГ при зниженій концентрації Т4 може свідчити про недостатність гіпофіза чи гіпоталамуса (вторинний гіпотиреоз). Такі випадки трапляються досить рідко. При гіпертиреозі синтез і секреція ТТГ у гіпофізі за принципом зворотного зв’язку блоковані високими рівнями Т4 і Т3.
Термін «субклінічний» буквально означає відсутність будь-яких клінічних проявів захворювання. Насправді наявність чи відсутність симптомів залежить від уваги лікаря, який оглядає хворого, і ставлення пацієнта до навіть незначних змін у своєму організмі. Лікарі часто не звертають уваги на такі скарги хворого, як незначне зниження праце–здатності, поганий настрій, порушення сну. Самі хворі звикають до періорбітальних набряків, списуючи їх на втому, безсоння. Пацієнти похилого віку пояснюють віковими змінами в організмі сонливість, млявість, повільність, забудькуватість, сухість шкіри й інші симптоми.
Такі симптоми дуже часто пов’язують з гіпотиреозом не при первинному огляді, а вже після встановлення відповідних гормональних зрушень при лабораторному дослідженні, що нерідко проводять за відсутності явної підозри на гіпотиреоз. Аналогічним чином низку симптомів вдається ретроспективно виявити й при субклінічному гіпотиреозі. Саме тому деякі автори вважають термін «субклінічний» не цілком правильним і пропонують термін «мінімальна тиреоїдна недостатність».
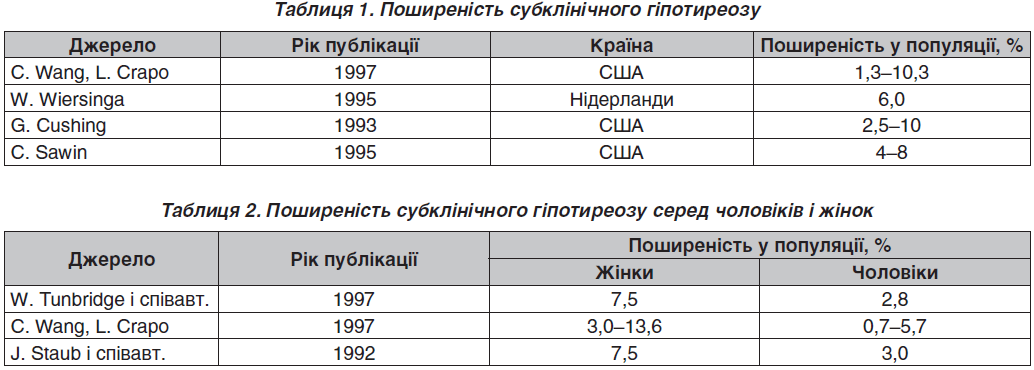
Субклінічний гіпотиреоз — досить поширений стан (табл. 1). Він приблизно втричі частіше трапляється в жінок, ніж у чоловіків (табл. 2). За даними Фремінгемського дослідження, з обстежених 892 чоловіків і 1256 жінок віком понад 60 років субклінічний гіпотиреоз було встановлено в 126 (5,9 %), причому серед жінок майже вдвічі частіше (7,7 проти 3,3 %).
За даними 20-річного Вікгемського (Whickham) дослідження, ризик розвитку гіпотиреозу безпосередньо залежить від початкового рівня ТТГ. Співвідношення ризику розвитку гіпотиреозу (Р) і початкового рівня ТТГ описується таким рівнянням:
ln{P/(1 – P)} = b0 + b1 · ln(ТТГ) + 0,027 · вік (+ 1,79).
Число 1,79 додають при підвищеному рівні антитіл до ЩЗ. При рівні ТТГ < 2 мОД/л b0 = –5,02; b1 = 0,3. При рівні ТТГ ≥ 2 мОД/л b0 = –6,38; b1 = 1,97.
Так, ризик розвитку гіпотиреозу протягом наступних 20 років у жінки 40 років із рівнем ТТГ 2,1 мОД/л становить менше ніж 1 до 50. За даними цього дослідження, ризик розвитку маніфестного гіпотиреозу в жінки за умови виявлення в неї підвищеного рівня ТТГ у поєднанні з підвищеним титром антитіл до ЩЗ становить 4,3 % за рік, при ізольованому підвищенні рівня ТТГ — 2,6 % за рік, а при ізольованому підвищенні рівня антитиреоїдних антитіл — усього 2,1 % за рік.
На сьогодні встановлена важливість субклінічного гіпотиреозу, тому закономірно постає питання про необхідність його активного виявлення. Як бачимо, субклінічний гіпотиреоз не має специфічних клінічних проявів, тому його діагностика, по суті, полягає у визначенні рівня ТТГ без особливих підстав, тобто виникає питання про доцільність скринінгового дослідження рівня ТТГ у дорослого населення. Це стосується не лише субклінічного, але й маніфестного гіпотиреозу, що має багато клінічних масок, у зв’язку з чим його клінічна діагностика буває утрудненою. Протягом першого року від початку захворювання правильний діагноз виставляють у 34 % випадків, а в 9 % хворих до початку адекватного лікування минає понад 10 років.
Єдиної думки про доцільність скринінгу на гіпотиреоз чи загалом на порушення функції ЩЗ у дорослих немає. Основним питанням є економічна ефективність масового дослідження рівня ТТГ у дорослого населення. А. Weetman не рекомендує піддавати скринінгу все здорове доросле населення, у той час як М. Danese і співавт. стверджують, що скринінгове обстеження обійдеться дешевше, ніж лікування наслідків вчасно не діагностованого гіпотиреозу, і рекомендує здійснювати скринінгове обстеження в жінок віком понад 35 років і всіх чоловіків віком понад 50 років. Рекомендації з діагностики порушень функції ЩЗ Американської тиреоїдної асоціації рекомендують скринінгове дослідження рівня ТТГ у всіх дорослих віком понад 35 років з інтервалом 5 років. Пропонується такий варіант скринінгу:
1. Визначення рівня ТТГ слід здійснювати всім жінкам віком понад 35 років і чоловікам віком понад 50 років.
2. Якщо рівень ТТГ ≤ 0,40 мМО/л, необхідне визначення рівнів вільних Т4 і Т3 для вирішення питання, про який варіант тиреотоксикозу йде мова — субклінічний чи явний.
3. Якщо рівень ТТГ становить від 0,41 до 2,00 мМО/л, подальше визначення рівня ТТГ здійснюється з інтервалом 5 років.
4. Якщо рівень ТТГ становить від 2,01 до 5,00 мМО/л, визначаються антитиреоїдні автоантитіла й вільний Т4.
У той же час необхідність періодичного дослідження рівня ТТГ у групах ризику розвитку гіпотиреозу визнається більшістю дослідників. До факторів ризику розвитку гіпотиреозу можна віднести наявність антитиреоїдних антитіл, ендокринні й неендокринні автоімунні захворювання, опромінення в анамнезі, будь-яку патологію ЩЗ чи її лікування в анамнезі, цукровий діабет, нестійкість настрою, депресивні стани, зниження пам’яті, гіперхолестеринемію й гіперліпідемію, безплідність, порушення менструального циклу, зниження слуху, хромосомні аномалії (синдром Дауна, Шерешевського — Тернера, Клайнфелтера), прийом лікарських препаратів, що впливають на функцію ЩЗ (літій, аміодарон та ін.), анемії, міалгії, міопатії.
У клінічній практиці виникають ситуації, коли у хворих на тлі еутиреозу та нормального рівня ТТГ спостерігається значне підвищення чи зниження вмісту загального Т4. Ці стани в зарубіжній літературі одержали назви «еутиреоїдна гіпертироксинемія» та «еутиреоїдна гіпотироксинемія».
Причиною гіпертироксинемії можуть бути збільшення тироксинзв’язуючої здатності білків крові, зменшення конверсії Т4 у Т3 і периферична резистентність до тиреоїдних гормонів.
Між вмістом ТТГ і рівнем Т4 у крові спостерігається обернена залежність, у випадку її відсутності слід здійснити повторні аналізи й уточнити діагноз.
Слід пам’ятати, що результати, отримані при використанні будь-якого діагностичного методу, можна інтерпретувати лише в поєднанні з клінічною картиною захворювання, а також даними інших методів діагностики.
У багатьох клініцистів постають проблеми при спілкуванні з пацієнтами із субклінічними тиреотоксикозом і гіпотиреозом — лабораторними феноменами із сумнівною клінічною складовою.
При цьому від лікаря вимагається терпіння як для здійснення динамічного спостереження, так і для вибору часу й обсягу лікування. Наявність антитіл до рецептора ТТГ, функціональної автономії або зоба допомагають у виборі тактики. А якщо ТТГ стійко знижений без інших проявів?
Виявлення низького рівня ТТГ неможливе при скринінгу новонароджених, оскільки тести скеровані лише на виявлення високих цифр ТТГ (пошук первинного гіпотиреозу), а вторинний гіпотиреоз визначається за низьким рівнем вільного Т4 (у багатьох країнах проводять скринінг за обома показниками).
Поширеність субклінічного гіпертиреозу становить від 0,7 до 6 %. Виділяють ендогенний субклінічний гіпертиреоз (автономна тиреотоксична аденома, функціональна автономія ЩЗ, багатовузловий токсичний зоб, дифузний токсичний зоб — стан після хірургічного, медикаментозного лікування або терапії радіоактивним йодом) та екзогенний субклінічний гіпертиреоз (передозування замісної терапії або надто інтенсивна супресивна терапія препаратами тиреоїдних гормонів).
У 2014 році виконавчий комітет Європейської тиреоїдної асоціації, враховуючи розбіжності щодо лікування ендогенного субклінічного гіпертиреозу, сформував робочу групу для розробки настанов для клінічної практики на принципах доказової медицини.
Нещодавні метааналізи, у тому числі на основі великих проспективних когортних досліджень, показали, що субклінічний тиреотоксикоз пов’язаний з підвищеним ризиком смерті внаслідок ішемічної хвороби серця, фібриляції передсердь, серцевої недостатності, переломів у пацієнтів із рівнем ТТГ < 0,1 мМО/л.
Відповідно до рівня ТТГ і вираженості виділяються два ступені субклінічного гіпертиреозу: I ступінь — при низьких показниках ТТГ (0,1–0,39 мМО/л), II ступінь — з показниками ТТГ нижче від 0,1 мМО/л.
Попри відсутність рандомізованих проспективних досліджень встановлено, що лікування показане пацієнтам віком понад 65 років із субклінічним гіпертиреозом II ступеня. Такий підхід дозволяє запобігти серйозним серцево-судинним подіям, переломам і ризику прогресування до явного гіпертиреозу.
Тому одним із основних завдань у практиці сімейного лікаря є рання діагностика субклінічного гіпертиреозу й призначення при цьому відповідного лікування із застосуванням тиреостатиків, що дозволяє відновити нормальну діяльність серця або запобігти прогресуванню серцево-судинних порушень у більш виражені форми серцевої недостатності.
В Україні за умов йодної недостатності, відсутності національної програми з профілактики йододефіцитних розладів, несприятливої екологічної ситуації рекомендується визначення ТТГ на початку лікування хворих з кардіологічною, гінекологічною, гастроентерологічною, неврологічною, дерматологічною та іншою патологією.
Успішність лікування й досягення стану компенсації тиреоїдної патології також визначається рівнем ТТГ.
У хворих із вузловою патологією ЩЗ слід обов’язково визначати рівень кальцитоніну.
Кальцитонін — гормон, що продукується С-клітинами ЩЗ, у поняття «тиреоїдні гормони» зазвичай не включається. Високий його вміст у крові є найважливішим діагностичним критерієм медулярного раку ЩЗ.
Конфлікт інтересів. Не заявлений.