Вступ
Катастрофічне зростання кількості населення з надлишком маси тіла різного ступеня є однією з найважливіших проблем сьогодення. На сьогодні кожен четвертий мешканець планети має надлишкову масу тіла (надлМТ), а ожиріння (ОЖ) визнано Всесвітньою організацією охорони здоров’я епідемією XXI століття [1].
Із розвитком поширеності ОЖ прогресивно збільшується й кількість пов’язаних з ним тяжких коморбідних патологій — цукрового діабету 2-го типу, артеріальної гіпертензії, ішемічної хвороби серця, онкологічних захворювань, що призводять до погіршення якості життя, ранньої втрати працездатності та передчасної смертності хворих [2].
Пацієнти з ОЖ, як правило, отримують медичну допомогу вже на етапі діагностики патології, пов’язаної з цим станом. Разом з тим, як свідчить світовий досвід, запобігти розвитку коморбідної патології можливо тільки при своєчасній діагностиці й ранньому адекватному персоніфікованому лікуванні пацієнтів не тільки з ОЖ, а й з надлишковою масою тіла, і це слід робити в першу чергу.
При розробці підходів до такого лікування слід звертати увагу на розвиток запалення в жировій тканині при надмірному її накопиченні, що істотно впливає на її метаболізм і секреторну функцію. Останнє відіграє провідну роль у розвитку коморбідної ОЖ патології [3].
Запалення в жировій тканині проявляється, крім іншого, її інфільтрацією нейтрофілами, лімфоцитами й макрофагами [4], що корелює зі ступенем, типом ОЖ та швидкістю його прогресування [5].
Макрофаги переважно локалізуються навколо гіпертрофованих і/або загиблих адипоцитів [6]. Можливо, однією з функцій макрофагів є апоптоз змінених жирових клітин [7]. Існує припущення: після того як макрофаги поглинули некротизовані адипоцити, вони самі, уже непотрібні, руйнуються і таким чином підтримують запальну реакцію.
Існують два фенотипи макрофагів: прозапальні (М1), що активуються класичним шляхом, і протизапальні (М2), що активуються альтернативно. У хворих на ОЖ у жировій тканині реєструється зсув у бік накопичення М1 макрофагів. Молекулярний механізм подібного зсуву пов’язують з експресією фактора транскрипції PPAR дельта/бета макрофагами. При блокаді PPAR дельта макрофаги втрачають властивості активуватися альтернативним шляхом [8].
Макрофаги в жировій тканині преформуються з адгезованих моноцитів. І спрямована міграція (хемотаксис) моноцитів, і преформування їх відбуваються за участі хемокінів (хемотаксичних цитокінів), які в значній кількості продукуються адипоцитами та запальними макрофагами М1 при ОЖ [9].
Суперродина хемокінів включає в себе понад 50 білків, у тому числі й фракталкін (єдиний хемокін класу СХ3С). Однією з важливих особливостей фракталкіну є здатність його до експресії як трансмембранного білка. Молекула фракталкіну складається з позаклітинного кінцевого хемокінового домену, муциноподібного стрижня, трансмембранного й внутрішньоклітинного доменів. Розчинна форма фракталкіну утворюється шляхом протеолітичного відщеплення з поверхні клітин позаклітинного хемокінового домену й частини муциноподібного стрижня. Мембранна форма фракталкіну має властивості молекули адгезії, тоді як розчинна форма діє як хемоатрактанти для моноцитів/макрофагів, а також цитотоксичних ефекторних Т-лімфоцитів і МК-клітин. Розчинна форма фракталкіну утворюється частіше за все під впливом протеаз, у тому числі ADAM17 — ферменту, що конвертується TNF-α, ADAM10 [10]. Фракталкін є лігандом високоселективного Gi-протеїнзв’язаного рецептора СХ3СЯ1, що експресується на певних субпопуляціях лейкоцитів. Посилення експресії фракталкіну та його рецептора при запаленні свідчить про те, що фракталкін і його рецептор відіграють важливу роль у розвитку не тільки запалення жирової тканини при ОЖ, але й багатьох захворювань, патогенез яких пов’язаний із запаленням і гіперактивацією імунної системи [11].
На сьогодні доведено важливу роль фракталкіну в патогенезі ревматоїдного артриту, запальних уражень кишечника, діабетичної нефропатії, онкопатології, псоріазу, септичних уражень, неврологічних захворювань тощо [12]. Доведено, що при хронічних запальних захворюваннях активація експресії фракталкіну відіграє негативну роль, а при патологічних станах, пов’язаних з імунною недостатністю, навпаки, — позитивну. Є дані, що підвищення експресії фракталкіну корелює з кращим прогнозом у пацієнтів з аденокарциномою шлунка [13].
Слід зазначити, що фракталкін розглядається і як маркер активності запального процесу, і як критерій ефективності лікування деяких захворювань [14].
Сімейство хемокінів, у тому числі й фракталкін, має вплив і на патогенез серцево-судинних захворювань: вони активують лейкоцити та сприяють їх адгезії до судинної стінки, посилюючи запалення в ендотелії. Хемокіни відіграють дуже важливу роль на всіх етапах прогресування патології — від формування атеросклеротичної бляшки до її розриву [15].
Встановлено, що фракталкін має антиапоптотичні властивості щодо клітин гладких м’язів, впливає на їх проліферацію, і, як наслідок, може мати велике значення в розвитку й прогресуванні судинної патології, при якій баланс проліферації гладком’язових клітин і процеси апоптозу відіграють найважливішу роль у розвитку стенозу судин [16].
За даними ряду досліджень [17], визначення рівня фракталкіну має велике значення як для прогнозування наявності атеросклеротичного ураження коронарних судин, так і для діагностики гемодинамічно значущого стенозу коронарних артерій, дифузного ураження коронарного русла, розвитку ендотеліальної дисфункції.
Щодо останнього, то крім того, що фракталкін — хемоатрактант і молекула адгезії, він викликає судинну дисфункцію ще й шляхом стимуляції продукції супероксидних аніонів, що призводить до зниження біодоступності NO. Пошкодження ендотелію судин за участі фракталкіну може також відбуватися через адгезію природних кілерів до ендотеліальних клітин, при цьому цитолітична активність NK-лімфоцитів збільшується в його присутності [18].
Існують і суперечливі дані щодо ролі фракталкіну. Є думка, що вплив фракталкіну на активність запальної реакції не завжди стимулюючий. Ймовірно, фракталкін є регулятором запальної відповіді, і спрямованість його дії залежить від концентрації в крові [11].
Крім того, в експерименті на лабораторних тваринах і в культурі людських клітин було доведено, що введення білка стимулює вироблення інсуліну й знижує толерантність до глюкози. Під час експериментів з’ясувалося, що фракталкін не тільки впливає на секрецію інсуліну, а й покращує стан, активізує диференціювання й запобігає апоптозу бета-клітин [14]. Останнє дає можливість позитивно впливати на процеси, що є основними ланками розвитку надлишкової маси тіла та ожиріння.
Доведено, що запалення в жировій тканині супроводжується розвитком інсулінорезистентності (ІР), посиленням ліполізу в адипоцитах і накопиченням ліпідів у печінкових клітинах [16]. Відомо три шляхи розвитку ІР під впливом запалення в жировій тканині: порушення секреції адипокінів, цитокінів та хемокінів; метаболічні зрушення, індуковані запаленням (насамперед підвищення концентрації насичених жирних кислот); власне запальна реакція в жировій тканині, особливо на внутрішньоклітинному рівні [3]. А це в генетично схильних осіб може призвести до розвитку цукрового діабету 2-го типу та серцево-судинної патології.
Неоднозначність ролі фракталкіну в розвитку коморбідної патології в осіб із надлишком жирової тканини обумовлює актуальність дослідження рівня фракталкіну в осіб із різною масою тіла залежно не тільки від індексу маси тіла (ІМТ), але й від маси жирової тканини, типу її відкладання та рівня інсуліну крові. Їх результати можуть стати основою для виділення груп ризику серед осіб із надлМТ та ОЖ щодо розвитку супутніх захворювань, у першу чергу з боку серцево-судинної системи.
З огляду на вищезазначене метою роботи стала оцінка рівня фракталкіну в мешканців м. Харкова — представників української популяції — залежно від індексу маси тіла, ступеня та топографії відкладання жирової тканини, рівня інсуліну в крові.
Матеріали та методи
Обстежено 250 мешканців м. Харкова, середній вік яких становив 65,48 ± 11,86 року. В усіх обстежених вимірювалася маса тіла і визначався ІМТ. За величиною ІМТ було сформовано 4 групи обстежених:
— група 1 — пацієнти з надлМТ (n = 62 особи; ч/ж = 46/16);
— група 2 — пацієнти з ОЖ I ступеня (n = 59 осіб; ч/ж = 39/20);
— група 3 — пацієнти з ОЖ II ступеня (n = 45 осіб; ч/ж = 23/22);
— група 4 — пацієнти з ОЖ III ступеня (n = 40 осіб; ч/ж = 17/23).
Контрольну групу становили 44 практично здорові особи з нормальною масою тіла (нМТ) (ч/ж = 18/26).
Наявність абдомінального ожиріння (абОЖ) визначалась у жінок при окружності талії (ОТ) > 0,80 м, у чоловіків — > 0,94 м [33]. Окремо під час дослідження виділено по дві підгрупи чоловіків і жінок, які мали помірне абОЖ [33] і виражене абОЖ, що поєднується з підвищеним ризиком розвитку супутньої патології. Критерієм відбору був показник ОТ: для чоловіків — від 0,94 до 1,02 м і понад 1,02 м відповідно, для жінок — від 0,8 до 0,88 м і понад 0,88 м відповідно.
У всіх обстежених, крім цього, визначалися окружність стегон (ОС) та співвідношення ОТ/ОС.
Для визначення жирової маси (ЖМ) та активної клітинної маси (АКМ) (маса усіх клітин без жирової маси, у яких відбуваються метаболічні процеси) обстежених використовувався програмно-апаратний комплекс «Діамант — АІСТ-ІРГТ» ЗАТ «Діамант».
Рiвень фракталкiну в сироватцi кровi хворих визначали iмуноферментним методом з використанням набору реактивiв Human Fractalkine ELISA Kit (RayBio®, Грузiя). Концентрацію інсуліну визначали імуноферментним методом із використанням комерційної тест-системи Insulin ELISA Kit виробництва фірми Monobind (США). Дослідження проводилися в біохімічному відділі центральної науково-дослідної лабораторії Харківського національного медичного університету МОЗ України на імуноферментному аналізаторі Labline-90 (Австрія).
В обстежених було визначено й індекс інсулінорезистентності (НОМА-ІR), який розраховувався за формулою: НОМА-IR = (глікемія натще (ммоль/л) · інсулін натще (мкОД/л))/22,5. Нормальним цей показник вважався на рівні від 0,0 до 2,7.
При обробці клініко-функціональних результатів використовувалися методи описового статистичного аналізу.
Результати
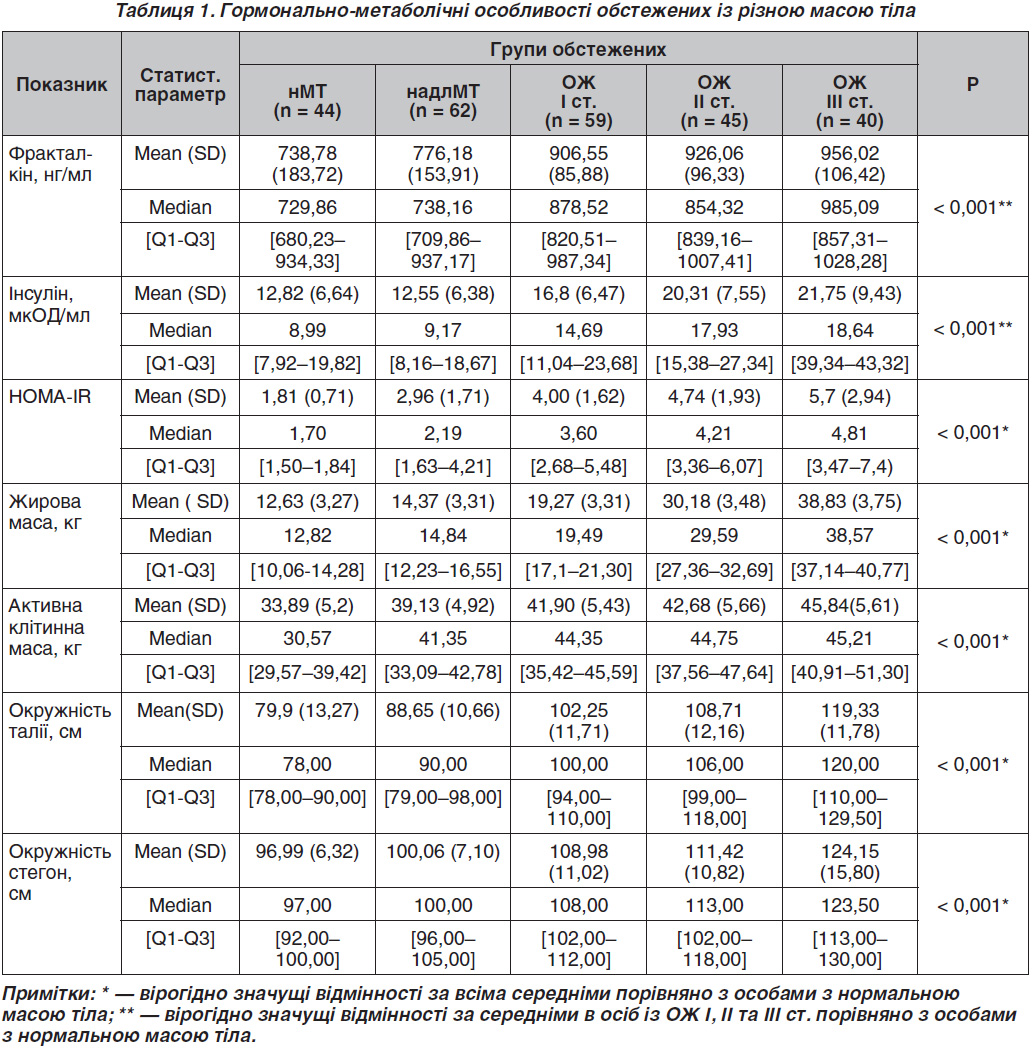
Результати комплексного обстеження осіб, які були залучені до дослідження, наведені в табл. 1.
Визначено, що в пацієнтів із ОЖ I, II і III ст. рівень фракталкіну в сироватці крові був статистично значуще вищим (p < 0,001, p < 0,001 та p < 0,001) порівняно з особами з нМТ. Одночасно в обстежених із надлМТ та нМТ не встановлено відмінностей щодо цього показника. Це може свідчити про менший ризик прогресування інфільтрації жирової тканини імунокомпетентними клітинами, меншу інтенсивність запалення в жировій тканині при надлМТ.
При дослідженні залежності між рівнем фракталкіну в сироватці крові й ІМТ виявлено прямий статистично значущий кореляційний зв’язок (рівень кореляції r = 0,4914).
Визначено рівняння регресії, згідно з яким рівень фракталкіну (нг/мл) становить [481,2036 + 11,6662 · ІМТ].
Згідно з науковими дослідженнями останніх років, з метаболічними характеристиками організму більшою мірою, ніж ІМТ, пов’язані показники складу тіла, зокрема жирова маса та активна клітинна маса. Саме аналіз цих показників дозволяє визначити спрямованість проведення лікувальних і оздоровчих заходів. Тому при проведенні даного дослідження було оцінено вміст фракталкіну в сироватці крові залежно від зазначених параметрів. Для визначення ЖМ та АКМ було застосовано метод біоімпедансного аналізу (БІА). БІА — це сучасний високоточний апаратний метод, заснований на вимірюванні електричного опору різних тканин людського тіла з огляду на різний вміст у них рідини та електролітів.
Встановлено, що в осіб із надлМТ, ОЖ I, II та III ст. ЖМ є більшою, ніж в осіб із нМТ, в 1,3; 2,1; 2,7 та 3,5 раза відповідно (p < 0,001) (табл. 1). Зареєстровано й зростання абсолютного значення АКМ — в 1,2; 1,2; 1,3 та 1,4 раза відповідно. Але відношення АКМ/ЖМ при збільшенні ІМТ знижувалось з 2,4 до 2,0; 1,4; 1,1 та 0,9.
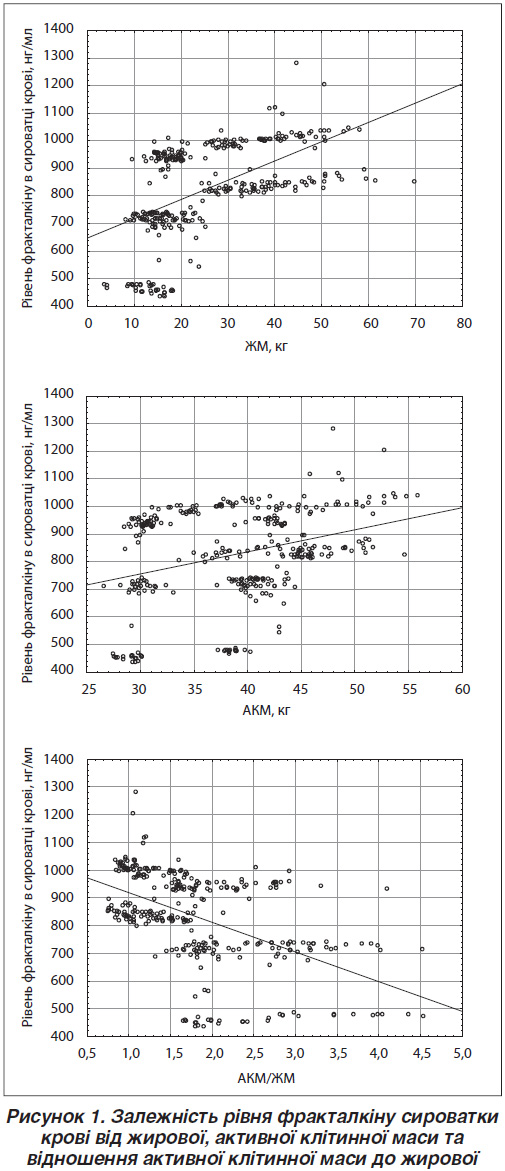
Щодо вмісту фракталкіну, то разом зі зростанням ЖМ і АКМ він також збільшувався (рис. 1): між рівнем цього хемокіну в сироватці крові й обома показниками виявлено прямий статистично значущий (p < 0,001) кореляційний зв’язок. Але ступінь кореляції дещо відрізняється: із ЖМ — r = 0,5341, із АКМ — r = 0,3215.
Визначені рівняння регресії, згідно з якими рівень фракталкіну (нг/мл) становить:
1) залежно від ЖМ [647,6886 + 6,9913 · ЖМ];
2) залежно від АКМ [516,6408 + 7,9847 · АКМ].
Між співвідношенням АКМ і ЖМ та активністю циркуляції фракталкіну виявлено негативний статистично значущий (p < 0,001) кореляційний зв’язок (ступінь кореляції r = — 0,5161). Рівняння регресії: фракталкін сироватки крові = 1029,436 – 109,3396 (АКМ/ЖМ). Отримані результати вказують на те, що по-перше, вміст фракталкіну у сироватці крові більшою мірою характеризує такий параметр, як ЖМ тіла, ніж ІМТ, а по-друге, підтверджує, що саме в жировій тканині синтезується цей хемокін.
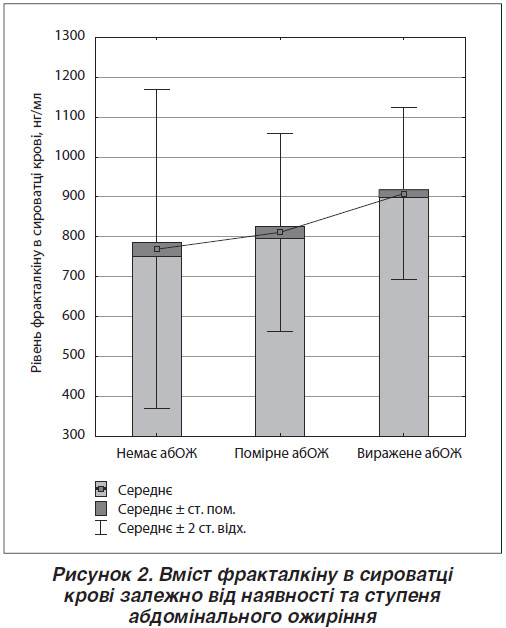
Результати дослідження рівня фракталкіну в сироватці крові залежно від топографії відкладання жирової тканини подано на рис. 2. Встановлено, що в осіб із наявністю вираженого абОЖ він є статистично значуще вищим як порівняно з особами з помірним абОЖ (p < 0,001), так і з тими, у кого ОТ не перевищує норму (p < 0,001) — 908,39 ± 9,70 нг/мл проти 812,85 ± 15,14 нг/мл та 769,21 ± 17,30 нг/мл відповідно.
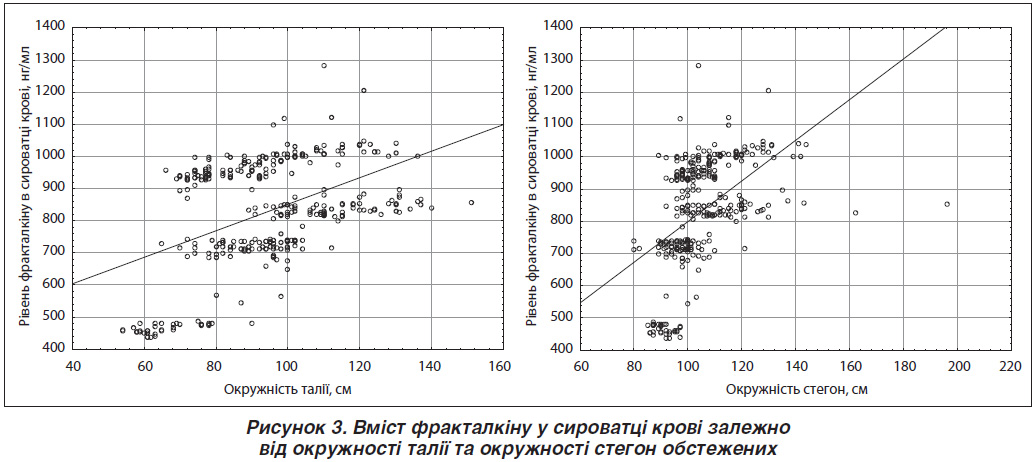
При дослідженні кореляційної залежності між рівнем фракталкіну в сироватці крові й ОТ та ОС виявлено прямий статистично значущий (p < 0,001) кореляційний зв’язок, причому більш виражений — з ОС (рівень кореляції r = 0,4542 та r = 0,5007 відповідно) (рис. 3).
Рівняння регресії: [Рівень фракталкіну сироватки крові (нг/мл) = 437,8005 + 4,1366 · ОТ] та [Рівень фракталкіну сироватки крові (нг/мл) = 148,9477 + 6,4657 · ОС].
Щодо співвідношення ОТ/ОС визначено, що воно дещо меншою мірою корелює із рівнем фракталкіну крові (r = 0,2199), але також цей зв’язок є статистично значущим (p < 0,001).
Тобто отримані результати засвідчують прямий зв’язок між рівнем фракталкіну крові та топографією відкладання жирової тканини, а отже, і розвитком запалення в ній.
З метою підтвердження впливу фракталкіну на секрецію інсуліну та чутливість тканин до нього було оцінено рівень фракталкіну крові залежно від вмісту інсуліну при різній масі тіла.
Визначено, що в обстежених з ОЖ I, II та III ст. рівень інсуліну був статистично значуще (p < 0,001) вищим, ніж в осіб із нМТ та надлМТ (табл. 1). Вміст інсуліну в крові в середньому в осіб із нМТ та надлМТ вірогідно не відрізнявся.
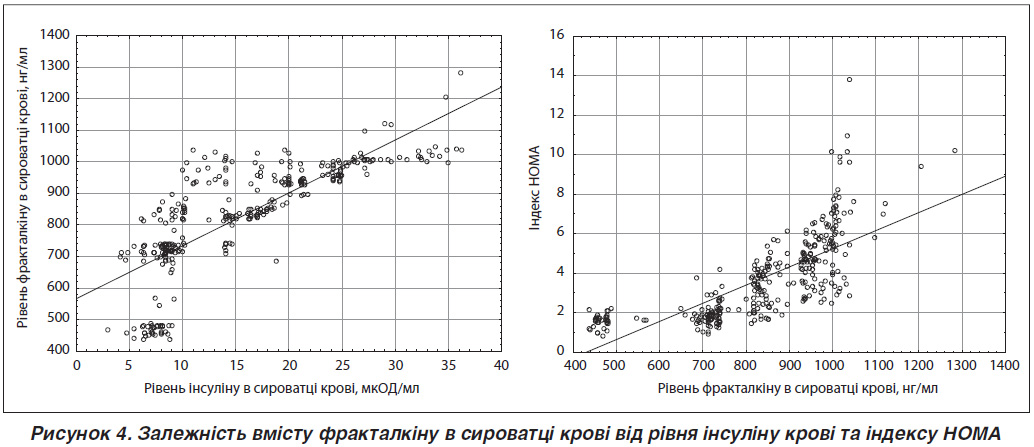
При зростанні рівня інсуліну відзначалося і збільшення фракталкіну (рис. 4). Кореляційний зв’язок цих двох параметрів був статистично значущим (рівень кореляції r = 0,7798, p < 0,001).
Рівняння регресії: [Рівень фракталкіну сироватки крові (нг/мл) = 565,9075 + 16,7963 · рівень інсуліну крові].
При оцінці НОМА-IR, який характеризує резистентність тканин організму до інсуліну, доведено, що в осіб із нМТ він не перевищував нормальних значень. У групі пацієнтів із надлМТ він реєструвався на рівні вище норми — 2,96 ± 1,71 і статистично значуще (p < 0,001, в 1,6 раза) відрізнявся від показника по групі обстежених із нМТ. Але найбільшим цей індекс був у пацієнтів із ОЖ. В осіб із ОЖ I, II та III ст. він перевищував середній показник по групі із нМТ в 2,2; 2,6 та в 3,1 раза відповідно.
Обговорення
При оцінці кореляційних зв’язків НОМА-IR із іншими параметрами, крім інсуліну, які були досліджені, встановлено, що найбільший рівень кореляції реєструвався між НОМА-IR і саме рівнем фракталкіну крові (r = 0,745, p < 0,001) (рис. 4) та ЖМ (r = 0,523, p < 0,001). Це ще раз підтверджує наявність зв’язку між ступенем жировідкладання, запаленням жирової тканини та чутливістю тканин організму до інсуліну.
Тобто при проведенні дослідження визначено деякі гормонально-метаболічні відмінності в осіб із надлМТ та ОЖ. Так, особи із надлМТ та нМТ мають статистично значущі відмінності таких антропометричних показників як ІМТ, ОТ, ОС, ЖМТ та АКМ. Але суттєвих змін у рівні фракталкіну крові в осіб із надлМТ порівняно особами з нМТ не встановлено. У осіб із ОЖ вже навіть I ст. відзначаються статистично значущі відмінності цього показника, що свідчить про наявність у них не тільки накопичення жирової тканини, але й розвитку запалення у неї. Доведено, що рівень фракталкіну крові корелює в першу чергу із ЖМ та інсуліном крові, індексом НОМА, а не з ІМТ та АКМ. Це вказує, що накопичення жирової тканини, а не зростання загальної маси тіла є визначальним фактором у розвитку запалення жирової тканини і воно має прямий зв’язок із чутливістю тканин до інсуліну.
У свою чергу, розвиток запалення в жировій тканині залежить від рівня інсулінорезистентності, що впливає на подальше накопичення жирової тканини, тобто спостерігається так зване хибне коло.
Отже, при розробці персоніфікованих підходів до лікування ОЖ обов’язково слід уточнювати факт наявності та ступеня запалення в жировій тканині, який деякою мірою характеризується рівнем у крові такого хемокіну, як фракталкін.
Висновки
На підставі визначення маркера активності запального процесу в жировій тканині (фракталкіну) в осіб із різною масою тіла — представників української популяції доведено, що хворі на ожиріння мають вірогідно вищий рівень фракталкіну, ніж пацієнти із надлишковою масою тіла, що свідчить про наявність збільшеного ризику розвитку запалення жирової тканини.
Визначено, що рівень фракталкіну крові в першу чергу пов’язаний із вмістом інсуліну в крові, НОМА індексом, окружністю стегон та жировою масою тіла.
Встановлено, що параметр «жирова маса тіла» є більш інформативним щодо рівня фракталкіну крові, ніж параметр «індекс маси тіла».
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. World Health Organization. Obesity and overweight. — 2016. — www.who.int/mediacentre/factsheets/fs311/en/.
2. Metabolic Risk Factors for Chronic Diseases Collaboration (BMI Mediated Effects) of the effects of body-mass index, overweight, and obesity on coronary heart disease and stroke: a pooled analysis of 97 prospective cohorts with 1.8 million participants // Lancet. — 2013. — doi:10.1016/S0140–6736 (13)61836-X.
3. Reduction of macrophage infiltration and chemoattractant gene expression changes in white adipose tissue of morbidly obese subjects after surgery-induced weight loss / R. Cancello, C. Henegar, N. Viguerie et al. // Diabetes. — 2005. — Vol. 54. — P. 2277-2286.
4. Obesity is associated with macrophage accumulation in adipose tissue / S.P. Weisberg, D. McCann, M. Desai et al. // J. Clin. Invest. — 2003. — Vol. 112. — P. 1796-1808.
5. Increased infiltration of macrophages in omental adipose tissue is associated with marked hepatic lesions in morbid human obesity / R. Cancello, J. Tordjman, C. Poitou et al. // Diabetes. — 2006. — Vol. 55. — P. 1554-1561.
6. Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans / S. Cinti et al. // J. Lipid Res. — 2005. — Vol. 46. — P. 2347-2355.
7. Adipocyte-derived Th2 cytokines and myeloid PPARdelta regulate macrophage polarization and insulin sensitivity / K. Kang, S.M. Reilly, V. Karabacak et al. // Cell Metab. — 2008. — Vol. 7. — P. 485-495.
8. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity / H. Kanda, S. Tateya, Y. Tamori et al. // J. Clin. Invest. — 2006. — P. 1494-1505.
9. Tumor necrosis factor-alpha-converting enzyme (ADAM17) mediates the cleavage and shedding of fractalkine (CX3CL1) / K.J. Garton, P.J. Gough, C.P. Blobel et al. // J. Biol. Chem. — 2001. — Vol. 276(41). — P. 7993-8001.
10. The disintegrin-like metalloproteinase ADAM10 is involved in constitutive cleavage of CX3CL1 (fractalkine) and regulates CX3CL1-mediated cell-cell adhesion / C. Hundhausen, D. Misztela, T.A. Berkhout, et al. // Blood. — 2003. — Vol. 102. — P. 1186-1195.
11. Increased expression of fractalkine is correlated with a better prognosis and an increased number of both CD8+ T cells and natural killer cells in gastric adenocarcinoma / M. Hyakudomi, T. Matsubara, R. Hyakudomi et al. // Ann. Surg. Oncol. — 2008. — Vol. 15(6). — P. 1775-1782.
12. Upregulation of fractalkine and its receptor, CX3CR1, is associated with coronary plaque rupture in patients with unstable angina pectoris / H. Ikejima, T. Imanishi, H. Tsujioka et al. // Circulation J. — 2010. — Vol. 74. — Р. 337-345.
13. Aspirin inhibits fractalkine expression in atherosclerotic plaques and reduces atherosclerosis in ApoE gene knockout mice / H. Liu, D. Jiang, S. Zhang, B. Ou // Cardiovascular Drugs and Therapy. — 2010. — Vol. 24. — Р. 17-24.
14. Fractalkine has antiapoptotic and proliferative effects on human vascular smooth muscle cells via epidermal growth factor receptor signaling / G.E. White, T.C. Tan, A.E. John et al. // Cardiovascular Res. — 2010. — Vol. 85. — Р. 825-835.
15. The CX3C chemokine fractalkine induces vascular dysfunction by generation of superoxide anions / A. Schkfer, C. Schulz, D. Fraccarollo et al. // Arterioscler. Thromb. Vasc. Biol. — 2007. — Vol. 27(1). — P. 55-62.
16. Dose-dependent differential regulation of cytokine secretion from macrophages by fractalkine / N. Mizutani, T. Sakurai, T. Shibata et al. // Immunology. — 2007. — Vol. 179. — P. 7478-7487.
17. The Fractalkine/CX3CR1 System Regulates β Cell Function and Insulin Secretion / Y.S. Lee, H. Morinaga, J.J. Kim et al. // Open Archive. — doi: http://dx.doi.org/10.1016/j.cell.2013.03.001.
18. The American Association of Clinical Endocrinologists and the American College of Endocrinology. 2014 Advanced framework for a new diagnosis of obesity as a chronic disease // www.aace.com. — Data of access: 21.09.2016.