Вступ
Цукровий діабет (ЦД) був і залишається актуальною проблемою сучасної ендокринології. Згідно з даними Міжнародної діабетичної федерації (МДФ), у 2015 році зареєстровано 415 млн дорослих людей із діабетом, а згідно з її прогнозом, у 2040 році буде 642 млн хворих на діабет.
Неалкогольна жирова хвороба печінки (НАЖХП) є однією з провідних причин непрацездатності, інвалідності, смертності хворих на ЦД. Відповідно до рекомендацій Європейської асоціації з вивчення печінки (EASL), цукрового діабету (EASD), ожиріння (EASO), що базувались на рішеннях спеціальної конференції 2016 року, НАЖХП характеризується надмірним накопиченням жиру в печінці, що пов’язано з інсулінорезистентністю, і визначається наявністю стеатозу в більше ніж 5 % гепатоцитів. В її розвитку виділяють стадію стеатозу печінки, стеатогепатиту, фіброзу та стеатогенного цирозу [1]. У 7 % хворих із компенсованим цирозом печінки внаслідок НАЖХП упродовж 10 років розвивається гепатоцелюлярна карцинома, близько 50 % із них потребують трансплантації печінки [2]. НАЖХП вражає 17–46 % дорослого населення європейських країн. До групи ризику прогресування НАЖХП і розвитку неалкогольного стеатогепатиту належать саме пацієнти з ЦД 2-го типу і метаболічним синдромом [1]. Також НАЖХП сприяє розвитку уражень серцево-судинної системи. Тому лікування НАЖХП у хворих на ЦД 2-го типу є актуальним і проблемним питанням на сьогодні.
Згідно з даними літератури, не існує єдиних установлених методів і ефективних медичних препаратів для лікування НАЖХП, зокрема й у пацієнтів із ЦД 2-го типу [3, 4]. Метою лікування НАЖХП є насамперед зниження прогресування ураження печінки, стеатозу і смертності від можливих ускладнень [5, 6]. Критеріями адекватного лікування НАЖХП у пацієнтів із ЦД 2-го типу є безпека, добра переносимість, відсутність поліпрагмазії і врахування коморбідних станів [1].
У світі та Україні впроваджують нанотехнології в різні сфери людської діяльності, зокрема створюють нові нанопрепарати для діагностики і лікування. Вчені Інституту хімії поверхні імені О.О. Чуйка НАН України спільно з ученими віт–чизняних науково-медичних закладів уперше у світі розробили, дослідили та впровадили в медичну практику препарат сорбційно-детоксикаційної дії на основі нанокремнезему силікс [7]. Але на підставі результатів спільних досліджень науковці Інституту хімії поверхні НАН України імені О.О. Чуйка та технологи НВ ТОВ «Житомирбіопродукт» створили детоксикаційний засіб на основі нанокремнезему у формі стабільної водної дисперсії, розробили промислову технологічну схему його виготовлення і випустили як харчовий продукт для спеціальних медичних цілей — гель-сорбент [8]. Застосування методів сорбційної детоксикації в терапії хворих на ЦД завжди було в центрі уваги співробітників кафедри ендокринології Національного медичного університету імені О.О. Богомольця [9, 10]. Експериментальне та клінічне обґрунтування методу ентеросорбції наводиться в числених публікаціях В.Г. Ніколаєва.
Метою даного дослідження є оцінка впливу аморфного нанорозмірного кремнезему на показники мультипараметричного ультразвукового дослідження неалкогольної жирової хвороби печінки в пацієнтів із цукровим діабетом 2-го типу.
Матеріали та методи
Дослідження проводилось на базі Київського міського клінічного ендокринологічного центру у 2015–2017 рр. Обстежено 111 хворих обох статей віком 18–79 років. Критерієм включення в дослідження була наявність ЦД 2-го типу в пацієнтів віком старше 18 років з індексом маси тіла (ІМТ) 25 кг/м2 і більше, які приймають метформін як монотерапію або метформін у комбінації з іншими цукрознижуючими засобами.
Критеріями виключення суб’єктів дослідження були: наявність антитіл до вірусних гепатитів В і С; зловживання алкоголем (споживання більше 30 г/день алкоголю для чоловіків і більше 20 г/день алкоголю для жінок); прийом наркотичних засобів; вагітність; пацієнти, які мають психічні захворювання; наявність шкідливих умов праці (із токсичним впливом на печінку), парентерального харчування, гемохроматозу, автоімунного гепатиту, целіакії, хвороби Вільсона — Коновалова, гіпопітуїтаризму, декомпенсованого гіпотиреозу, синдрому гіперкортицизму, вродженого дефіциту лізосомної кислої ліпази (хвороба Вольмана), ЦД 1-го типу, хвороби Крона.
З дослідження було виключено 6 пацієнтів у зв’язку з наявністю антитіл до вірусного гепатиту В (HBsAg) (одна особа) і до вірусного гепатиту С (сумарні антитіла) (5 осіб).
Усім 105 пацієнтам було проведено одномоментне УЗД органів черевної порожнини на приладі Soneus P7 (Ultrasign, Україна) із конвексним датчиком 1–6 МГц правої частки печінки, що включало В-режим, допплерографію (-метрію), компресійну і зсувнохвильову еластографію (-метрію), вимірювання гепаторенального індексу, стеатографію (-метрію). У В-режимі оцінювали положення печінки (відношення її до краю реберної дуги, доступність акустичних вікон).
Досліджували обидві частки печінки і проводили біометрію їх передньозаднього розміру при спокійному диханні пацієнта; описували контур (рівний чи нерівний) і передньонижній кут печінки (гострий чи заокруглений); ехогенність печінки (нормальна, знижена, підвищена); ехоструктуру (дрібнозернисту — 1–2 мм, середньозернисту — 3–4 мм і великозернисту — 5 і більше мм). У В-режимі за критеріями М. Hamaguchi оцінювали звукопровідність паренхіми печінки або згасання ультразвуку за товщиною печінки в передньозадньому напрямку [11]. На однаковій глибині вимірювали гепаторенальний індекс [12], коефіцієнт згасання ультразвуку, у паренхімі печінки виконували УЗ-стеатографію і стеатометрію за 2D-технологією кількісного виміру концентрації жирових крапель у режимі реального часу, розробленою українськими вченими (патент UA № 20141111234). Стадіювання стеатозу за результатами УЗ-стеатометрії проводили за шкалою згасання УЗ, запропонованою М. Sasso et al., що валідизована за морфологічною шкалою жирової інфільтрації NAS [13, 14].
УЗ-допплерографію з допплерометрією портальної вени проводили за загальноприйнятою методикою з урахуванням метаболічної активності органів травлення і селезінки. Методику зсувнохвильової еластографії та фіброеластометрії/зсувнохвильової еластометрії здійснювали за встановленим алгоритмом із врахуванням можливого виникнення артефактів для визначення ступеня фіброзу і цирозу за шкалою Metavir (впроваджена в клінічну практику шкала оцінки жорсткості печінки Castera et al.) у кПа [15–17].
Для діагностики НАЖХП було застосовано принцип одномоментного мп-УЗ органів черевної порожнини з оцінкою даних В-режиму, допплерографії (-метрії), компресійної і зсувнохвильової еластографії (-метрії), стеатографії (-метрії), що реалізовані за допомогою одного приладу Soneus P7 (Ultrasign, Україна), у 105 пацієнтів із ЦД 2-го типу, серед яких були 81 жінка і 24 чоловіки. Вік пацієнтів становив 57,75 ± 8,62 року, тривалість ЦД 2-го типу — 10,19 ± 5,99 року, максимальне значення стеатозу печінки — 2,60 ± 0,31 дБ/см, максимальне значення еластографії правої частки печінки — 6,70 ± 1,47 кПа, лівої частки печінки — 6,50 ± 1,42 кПа, гепаторенальний індекс — 1,55 ± 0,36, розміри правої частки — 161,80 ± 16,36 мм, розміри лівої частки — 72,95 ± 12,53 мм, діаметр ворітної вени — 11,73 ± 1,31 мм, максимальна лінійна швидкість кровотоку портальної вени — 25,49 ± 5,07.
105 пацієнтів були розподілені на такі групи: основну групу становили 69 пацієнтів, а групу порівняння — 36. Розподіл пацієнтів за групами здійснювався за принципом випадковості. Основній групі для лікування НАЖХП було застосовано аморфний нанорозмірний кремнезем у суспензії в дозі 60 мл тричі на день через 1,5–2 години після їжі/прийому ліків або за 1,5–2 години до їжі/прийому ліків протягом 10 днів. В основній групі 34 пацієнти приймали один курс ентеросорбції і 35 пацієнтів — повторний курс ентеросорбції в цій же дозі протягом 10 днів із перервою у два тижні. Повторне обстеження пацієнтів проводилось через 2,5–3 місяці з моменту початку першого курсу ентеросорбції. Групу порівняння становили 36 пацієнтів, які знаходилися на традиційний терапії. Усім пацієнтам були надані рекомендації щодо дотримання режиму раціонального харчування та дозованого фізичного навантаження. Остаточні результати були отримані в 67 із 69 пацієнтів основної групи (33 і 34 відповідно за методами лікування) і в 34 із 36 хворих групи порівняння. Для оцінки різниці кількісних показників використовували t-критерій Стьюдента та метод множинних порівнянь (критерій хі-квадрат). Статистично значущим вважали p < 0,05.
Аморфний нанорозмірний кремнезем за фізико-хімічними властивостями є непористим, питома поверхня становить 300 г/м2 і являє
собою частинки сферичної форми діаметром ~ 10 нм. На поверхні наночастинок знаходяться поодинокі ізольовані гідроксильні групи ≡Si-OH (вільні силанольні групи), гідроксильні групи, що зв’язані взаємним водневим зв’язком, а також сорбована вода [8]. Нанокремнезем відповідає усім вимогам, установленим для ентеросорбентів, а саме: нетоксичний (не руйнується до компонентів, що при всмоктуванні здатні прямо або опосередковано впливати на органи і системи); нетравматичний для слизових оболонок; евакуація з кишечника без посилення процесів, що викликають диспептичні порушення; висока сорбційна ємність щодо компонентів хімусу, які видаляються; відсутність десорбції речовин у процесі евакуації і зміни рН середовища, здатної призвести до несприятливих проявів; зручна фармацевтична форма препарату, що дає змогу його використовувати протягом тривалого часу; відсутність негативних органолептичних властивостей сорбенту [18]. За протеонектичними (білоксорбуючими) властивостями нанорозмірний кремнезем переважає більшість сучасних ентеросорбентів і, відповідно, має неспецифічну протеонектичну активність, високу сорбційну ємність щодо мікробів (108–1010 мікробних тіл/г) незалежно від їх виду та має широкий адсорбційний спектр. Лікувальна дія сорбенту полягає в сорбції речовин, що беруть участь у гепато- і гемоентеральній циркуляції і утворюються в кишечнику при гідролізі їжі. Крім того, сорбент призводить до подразнення рецепторів і стимуляції функціональної активності органів травлення, зменшення метеоризму [19]. Нанокремнезем у формі суспензії гелю-сорбенту «Ан-нушка» зручний для дозування, не розшаровується і стійкий до умов навколишнього середовища.
Результати
Ефективність аморфного нанорозмірного кремне––зему оцінювалась за ультразвуковими показниками: максимальним значенням стеатометрії (вимірювання коефіцієнта згасання в дБ/см), еластографії правої та лівої часток печінки в кПа; гепаторенальним індексом; розміром правої частки в кПа; розміром лівої частки в кПа; діаметром ворітної вени в мм та лінійною швидкістю кровотоку ворітної вени в см/с.
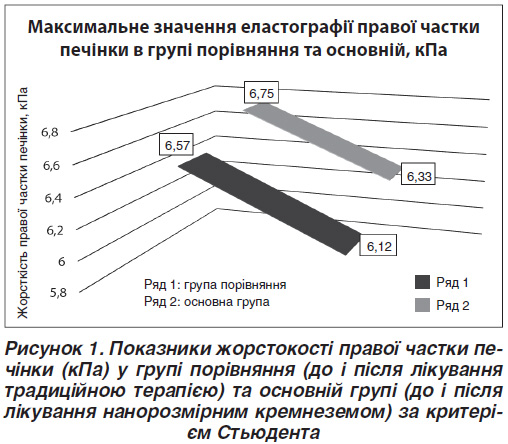
Згідно з проведеним статистичним аналізом основної групи і групи порівняння було виявлено зменшення максимальних значень еластографії правої частки печінки в основній групі після лікування нанорозмірним кремнеземом (р = 0,006), тоді як у групі порівняння цього не було досягнуто (р = 0,091) (рис. 1). У групі порівняння до лікування традиційною терапією еластографію правої частки печінки було виконано в 35 із 36 пацієнтів (97 %), що пов’язано з метеоризмом, а після — у 33 із 34 (97 %). В основній групі до лікування нанорозмірним кремнеземом еластографію правої частки було виконано в 66 пацієнтів із 69 (96 %), тоді як після лікування — у 64 з 67 (95,5 %).
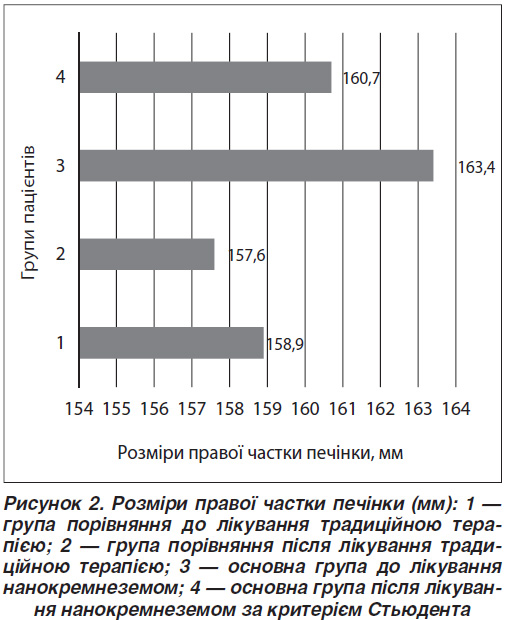
Виявлено значне зменшення розмірів правої частки печінки в основній групі після лікування нанорозмірним кремнеземом (р = 0,006), тоді як у групі порівняння цього не було досягнуто (р = 0,091) (рис. 2). Розміри правої частки печінки було визначено в 36 пацієнтів у групі порівняння до традиційної терапії і в 34 — після неї. В основній групі розміри правої частки печінки було визначено в 69 пацієнтів до лікування нанорозмірним кремнеземом і в 67 пацієнтів — після нього.
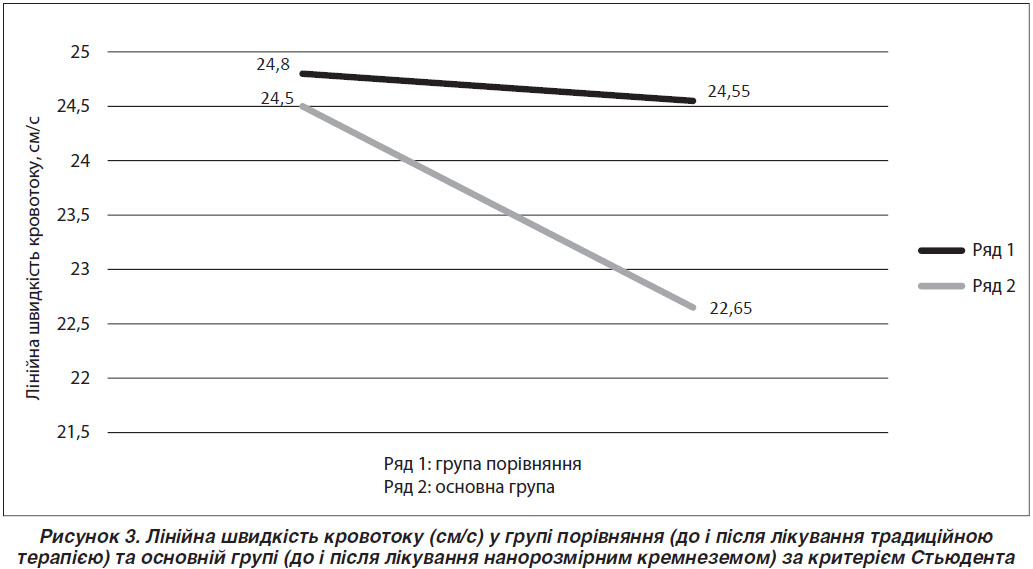
Виявлено статистично значуще зменшення показника лінійної швидкості кровотоку ворітної вени в основній групі після лікування нанорозмірним кремнеземом (р < 0,001), тоді як у групі порівняння цього не було досягнуто (р = 0,557) (рис. 3). У групі порівняння до лікування традиційною терапією вимірювання лінійної швидкості кровотоку було виконано в 34 із 36 пацієнтів (94 %), а після нього — у 34 із 34 (100 %). В основній групі до лікування нанорозмірним кремнеземом вимірювання лінійної швидкості було виконано в 64 пацієнтів із 69 (93 %), тоді як після лікування — у 62 із 67 (93 %).
Максимальне значення еластографії лівої частки, гепаторенального індексу, розміри лівої частки та діаметр ворітної вени не досягнули статистичної значущості в основній групі та в групі порівняння. Максимальне значення вимірювання коефіцієнта згасання при виконанні статистичного аналізу також не досягнуло значущості: у групі порівняння — р = 0,391 і в основній групі — р = 0,089.
Для визначення ефективності нанорозмірного кремнезему було використано методику множинних порівнянь із метою виявлення ефективності обраного методу лікування за критерієм прогресування і стабілізації процесу. При оцінці показника максимального значення еластографії правої частки печінки за допомогою критерію прогресування процесу було визначено перехід стадії фіброзу в більшу стадію відповідно до результату певного методу лікування (табл. 1). У 7 пацієнтів у групі порівняння за даними еластографії після проведеної традиційної терапії стався перехід з F0 (фіброз відсутній) у F1 (фіброз легкого ступеня) у трьох пацієнтів; із F0 (фіброз відсутній) у F2 (помірний фіброз) в одного пацієнта та з F1 (фіброз легкого ступеня) у F2 (помірний фіброз) у трьох пацієнтів. Також при оцінці показника розміру правої частки печінки за допомогою критерію прогресування процесу було визначено збільшення передньозаднього розміру печінки на 1 мм (табл. 1).
Ефективність лікування залежить від обраної методики (за критерієм хі-квадрат р < 0,001). За даними еластографії правої частки: групи І, ІІ: Chi-square = 7,26, р = 0,027; групи І, ІІІ: Chi-square = 7,45, р = 0,024; групи ІІ, ІІІ: Chi-square = 0, р = 1,000. Один курс ентеросорбції і повторний курс ентеросорбції дають менший відсоток прогресування жорсткості паренхіми печінки, ніж традиційна терапія. За даними розмірів правої частки печінки: групи І, ІІ: Chi-square = 3,81, р = 0,149; групи І, ІІІ: Chi-square = 13,41, р = 0,001; групи ІІ, ІІІ: Chi-square = 1,94, р = 0,379. Повторний курс ентеросорбції дає менший відсоток збільшення розмірів правої частки печінки.
При оцінці показника розміру лівої частки печінки за допомогою критерію прогресування процесу було визначено збільшення передньозаднього розміру печінки на 1 мм (табл. 2).
Ефективність лікування залежить від обраної методики (за критерієм хі-квадрат р < 0,001). Групи І, ІІ: Chi-square = 2,80, р = 0,247; групи І, ІІІ: Chi-square = 13,41, р = 0,001; групи ІІ, ІІІ: Chi-square = 2,83, р = 0,242. Повторний курс ентеросорбції дає менший відсоток збільшення розмірів лівої частки печінки.
Методика множинних порівнянь допомагає визначати ефективність обраного методу лікування за критерієм прогресування і стабілізації процесу.
Обговорення
Ентеросорбція належить до еферентної терапії і є інтракорпоральним методом детоксикації, що ґрунтується на поглинанні і виведенні з шлунково-кишкового тракту ендогенних або екзогенних токсинів, надмолекулярних структур та клітин із використанням сорбентів [9]. Цей метод широко застосовується в медицині для лікування захворювань шлунково-кишкового тракту, атеросклерозу, вірусних і токсичних гепатитів. Відомо, що ЦД 2-го типу та ожиріння супроводжуються системним низькоградієнтним запаленням.
Надмірне і нераціональне харчування, депресія, малорухомий спосіб життя, гіперглікемія, ендотоксини на тлі генетичної схильності призводять до метаболічного стресу і гіпоксії жирової тканини [20]. Зменшення максимального значення еластографії правої частки печінки і прогресування жорсткості паренхіми правої частки печінки в основній групі пояснюються протизапальним ефектом нанокремнезему, оскільки з даних літератури відомо, що цей сорбент має неспецифічну протеонектичну властивість і використовується в комплексному лікуванні гнійно-запальних, інфекційних, онкологічних та інших захворювань [10, 19].
У пацієнтів із ЦД 2-го типу були виявлені зменшення розмірів правої частки печінки і статистично значуще зменшення прогресування розмірів правої і лівої часток печінки. Ці дані збігаються з показниками експериментального застосування кремнезему в мишей, яких вигодовували атерогенною дієтою, у результаті чого в цих тварин розвивався гепатоз. Після лікування сорбентом розміри печінки мишей зменшувались, хоч і не досягали норми [7]. Окрім цього, у пацієнтів були виявлені зниження лінійної швидкості кровотоку ворітної вени, зменшення прогресування діаметра і кровотоку ворітної вени.
Висновки
Аморфний нанорозмірний кремнезем має гепатопротекторний ефект, що проявляється зменшенням показників як еластографії правої частки печінки, розмірів правої частки печінки, зниженням лінійної швидкості кровотоку, а також зменшенням прогресування жорсткості паренхіми правої частки печінки, розмірів правої і лівої часток печінки, діаметра ворітної вени, зниженням лінійної швидкості кровотоку ворітної вени.
Усе вищезгадане дає нам право рекомендувати аморфний нанорозмірний кремнезем для лікування НАЖХП у хворих на ЦД 2-го типу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті. Ця стаття не отримала фінансової підтримки від державної, громадської або комерційної організації.
Список литературы
1. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease [Text] // J. Hepatol. — 2016. — Vol. 64. — P. 1388-1402.
2. Кобиляк Н.М. Сучасні підходи до діагностики та скринінгу метаболічних порушень у хворих із неалкогольною жировою хворобою печінки [Текст] / Н.М. Кобиляк, О.Б. Динник, Д.В. Кирієнко // Міжнародний ендокринологічний журнал. — 2015. — № 5(69). — С. 89-99.
3. Mazzella N. The role of medications for the management of patients with NAFLD [Text] / N. Mazzella, L.M. Ricciardi, A. Mazzotti, G. Marchesini // Clin. Liver. Dis. — 2014. — Vol. 18. — P. 73-89.
4. Ratziu V. Current efforts and trends in the treatment of NASH [Text] / V. Ratziu, Z. Goodman, А. Sanyal // J. Hepatol. — 2015. — Vol. 62. — P. 65-75.
5. Singh S. Fibrosis progression in nonalcoholic fatty liver vs nonalcoholic steatohepatitis: a systematic review and meta-analysis of paired-biopsy studies [Text] / S. Singh, A.M. Allen, Z. Wang, L.J. Prokop, M.H. Murad, R. Loomba // Clin. Gastroenterol. Hepatol. — 2015. — Vol. 13. — P. 643-654.
6. Hafliddadotir S. Long-term follow up and liver-related death rate in patients with non-alcoholic and alcoholic related fatty liver disease [Text] / J.G. Jonasson, H. Norland, S.O. Einarsdottir, D.E. Kleiner, S.H. Lund et al. // BMC Gastroenterol. — 2014. — Vol. 14. — P. 166.
7. Чуйко А.А. Структура и физико-химические свойства поверхности кремнезема [Текст] / А.А. Чуйко. Медицинская химия и клиническое применение диоксида кремния. — K., 2003. — С. 10-20; 273-286.
8. Воронін Є.П. Cтворення стабільних водних дисперсій нанорозмірного кремнезему як сорбційно-детоксикаційного засобу медичного призначення [Текст] / Є.П. Воронін, Л.В. Носач, Є.М. Пахлов та ін. // Поверхность. — 2016. — № 8(23). — С. 267-283.
9. Боднар П.М. Терапевтический эффект энтеросорбции при сахарном диабете [Текст] / П.М. Боднар, Р.М. Дониш // Терапевтический архив. — 1988. — № 7. — С. 17-21.
10. Садик А.И. Джарадат. Опыт применения Силикса в лечении стеатоза печени у больных сахарным диабетом типа 2 [Текст] / А.И. Садик Джарадат // Науч. вестн. нац. мед. у-та имени А.А. Богомольца. — 2007. — № 2–3. — С. 91-93.
11. Hamaguchi M. The Severity of Ultrasonographic Findings in Nonalcoholic Fatty Liver Disease Re ects the Metabolic Syndrome and Visceral Fat [Text] / M. Hamaguchi, T. Kojima, Y. Itoh et al. // American J Gastroenterol. — 2007. — Vol. 102. — P. 2708-2715.
12. Chauhan A. Diagnostic accuracy of hepatorenal index in the detection and grading of hepatic steatosis [Text] / A. Chauhan, R.L. Sultan, L. Furth et al. // J. Clin. Ultrasound. — 2016. — Vol. 44(9). — P. 580-586.
13. Sasso M. Novel Controlled Attenuation Parameter (CAP™) for non-invasive assessment of steatosis using FibroScan®: validation in chronic hepatitis C [Text] / M. Sasso, I. Tengher-Barna, M. Ziol [et al.] // J. Viral Hepatitis. — 2011. — Vol. 19. — P. 224-253.
14. Stern C. Noninvasive diagnosis of hepatic steatosis [Text] / C. Stern, L. Castera // Hepatol. International. — 2017. — Vol. 11(1). — P. 70-78.
15. Castera L. Non-invasive evaluation of liver fibrosis using transient elastography [Text] / L. Castera, X. Forns, A. Alberti // J. Hepatol. — 2008. — Vol. 48. — P. 835-847.
16. European Association for the Study of the Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: non-invasive tests for evaluation of liver disease severity and prognosis [Text] // J. Hepatol. — 2015. — Vol. 63. — P. 237-264.
17. Ferraioli G. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: Part 3: liver [Text] / G. Ferraioli, C. Filice, L. Castera [et al.] // Ultrasound Med. Biol. — 2015. — Vol. 41(5). — P. 1169-1171.
18. Геращенко І.І. Ентеросорбенти: лікарські засоби і дієтичні добавки / І.І. Геращенко. — Київ: НАН України, ІХП ім. О.О. Чуйка, 2014. — 250 с.
19. Ніколаєв В.Г. Сорбційні матеріали і механізми дії [Текст] / В.Г. Ніколаєв, Н.І. Гуріна // Клінічна еферентологія. — 2010. — № 4. — С. 5-15.
20. Зак К.П. Гормоны жировой ткани (адипоцитокины) и сахарный диабет: современные представления о роли цитокинов в патогенезе сахарного диабета 2-го типа [Текст] / К.П. Зак, Н.Д. Тронько, В.В. Попова, А.К. Бутенко // Сахарный диабет. Иммунитет. Цитокины. — К.: Книга-плюс, 2015. — С. 402-406.